Галогенопроїзводниє вуглеводнів: алкіл-, арил-, вінілгалогеніди. Реакція заміщення і відщеплення.
До гомологічного ряду галогеналканов належать соеди-вати групи C-Х, де X = F, Cl, Br або I. Нижче перераховані деякі члени цього ряду:
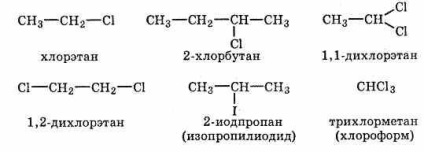
Існують три типи галогеналканов - первинні, вторинний Цінні та третинні:
1. Летючість. Молекули фтор, хлоралканов полярні, тому що електронний торгівельний галогенів і вуглецю:
Зв'язки С-F і С-Сl сильно полярні, що призводить до прітяж-нию між диполями сусідніх молекул:
2. Температури кипіння фтор і хлоралканов близькі до темпера-турах кипіння вуглеводнів з такою ж молекулярної мас-сой. Молекули бром- і іодалканов малополярни. Атом брому має таку ж масу, як шість груп -СН2 -, але розміри молекули бромалкана набагато менше, ніж молекули алкана рівної маси. Менший розмір молекул призводить до уменьше-нию взаємодії між ними і до більш низькій температурі кипіння.
Температура кипіння бром- і іодалканов значно нижче температури кипіння алканів з тієї ж молекулярної масою.
3. Розчинність. Галогенопроїзводниє погано розчиняються у воді.
4. Запах. Галогеналкани мають солодкуватий запах (трохи тош-нотворний).
5. Щільність. Хлоралкани легше води, а бром і іодалкани - важче.
У промисловості найбільше значення мають хлоралкани, так як хлор легко доступний (його отримують електролізом розчину NaCl). Хлоралкани отримують в промисловості з алканів і хлору. Хлорування алканів приводить до суміші монох-лор і поліхлоралканов, компоненти якої можуть бути виокрем-лени перегонкою. Чисті монохлорид можуть бути отримані приєднанням хлороводню до алкенам, які є продуктами переробки нафти:
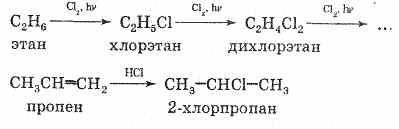
Можна отримати хлоралкани зі спиртів і хлороводню:
Тетрахлорметан отримують, пропускаючи хлор в сірковуглець CS2 в присутності каталізатора АlСl3:
Фторування алканів не знаходить практичного застосування. Це занадто складний процес. Однак поліфторхлоралка-
ни (фреони) широко застосовують в якості холодоагентів. Наибо-леї поширений фреон отримують:
1) як розчинники для жирів і масел;
2) в якості холодоагентів (наприклад, дихлорметан CCl2 H2);
3) при гасінні пожеж (наприклад, CBr2 ClF - дібромфторхлорметан).
^ Хімічні властивості галогеналканов
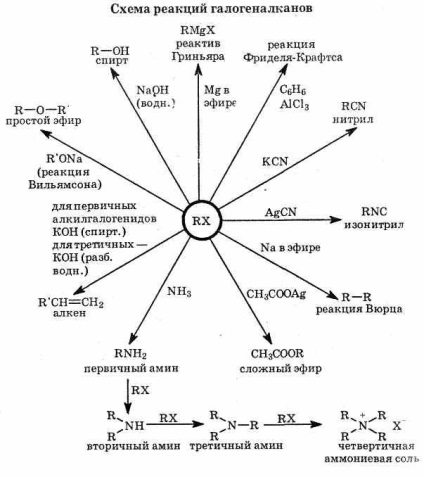
1. галогеналкани легко вступають в реакції заміщення. Це пов'язано з тим, що зв'язок С-Г полярна і на атомі вуглецю є частковий позитивний заряд (). Тому атом вуглецю легко атакується нуклеофилами, такими, як аніони ОН - і CN -. або сполуками з неподіленими електронними парами: NH3 і Н2 О. Галогенід-іон є, як кажуть, «хорошою йдучи щей групою», тому реакції заміщення йдуть досить легко:
Прикладами таких реакцій служить перетворення галогеналканов в спирти і аміни:
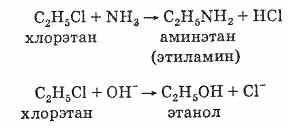
Умови, необхідні для протікання таких реакції, силь-но залежать від будови галогеналкани і природи нуклеофіла. У деяких випадках достатньо простого змішування реагентів, в інших - потрібне тривале нагрівання.
Легкість заміщення атома галогену в значній мірі залежить і від природи галогену. Енергія зв'язку ВІД збільшується в ряду С-I<С—Br<С—Сl<С—F. В этом же ряду уменьшается реакционная способность галогеналканов. Связь С—F настолько прочна, что фторалканы практически не вступают в реакции нуклеофильного замещения. Активность остальных галогеналканов по отношению к нуклеофилам падает в ряду RI>RBr> RCl.
2. галогеналкани також легко вступають в реакції отщепляя-ня. При цьому утворюються галогеноводородами і алкен. Ці реакції протікають при дії підстави на галогеналкани. Таким обра-зом, при дії сильних підстав на галогеналкани отщеп-ляють молекули НГ і утворюються алкени:
Швидкості заміщення і відщеплення залежать також від струк-тури вуглеводневої радикала. Роль реакції заміщення віз-розтане в наступному ряду галогеналканов:
первинні <Вторичные <Третичные
Третинні галогеналкани вступають в реакцію заміщення особливо легко (за відсутності сильного підстави):
В цілому в присутності водного розчину підстави для пер-первинних галогеналканов характерні в основному реакції відщеплення, вторинні галогеналкани дають, як правило, суміш про-дуктів відщеплення і заміщення, а третинні утворюють головним чином продукти заміщення.
Галогеналкани вступають в SN-реакція з різними нуклеофилами, такими, як ціанід-аніон CN -. ацетат-аніон
СН3 СОO -. аміак: NH3. аміни RN. H2 і багато інших.
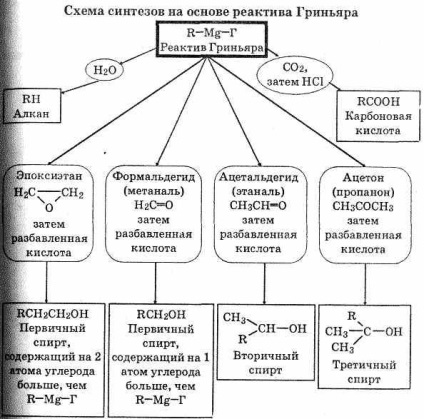
3. При додаванні розчину галогеналкани в діетиловому ефірі СН3 СН2 ОСН2 СН3 до магнієвої стружці відбувається екзотер-мическая реакція: магній переходить в розчин і утворюється ре-актив Гриньяра формули R-Mg-Г, де R - алкильная або арильна група, а Г - галоген.
RГ Mg ефір R-Mg-Г
Реактиви Гриньяра вступають в реакції з багатьма з'єднань-нями, що дозволяє використовувати їх в синтезі найрізноманітніших речовин.
^ 4.2. Галогеналкіл (вінілгалогеніди)
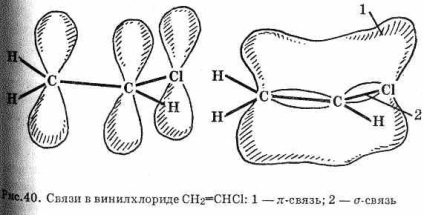
Реакційна здатність галогеналкенов дуже мала. Галоген- алкени, в яких атом галогену пов'язаний з sp 2 -гібрідізірованним атомом вуглецю, дуже інертні. Вони не гідролізуються лугами і не реагують з іншими нуклеофилами. Це пояснити-ється частковим перекриттям р-орбіталей атомів вуглецю при подвійному зв'язку і атома галогену (див. Рис. 40). В результаті зв'язку С-Г виявляються значно міцніше, ніж в галогеналканами, де вона утворена тільки -електронами.
Полімеризацією галогеналкенов отримують багато важливих матеріали, наприклад ПВХ (полівінілхлорид).
З'єднання, в яких атоми галогену з'єднані з атомами вуглецю бензольного кільця, називаються галогенаренамі.
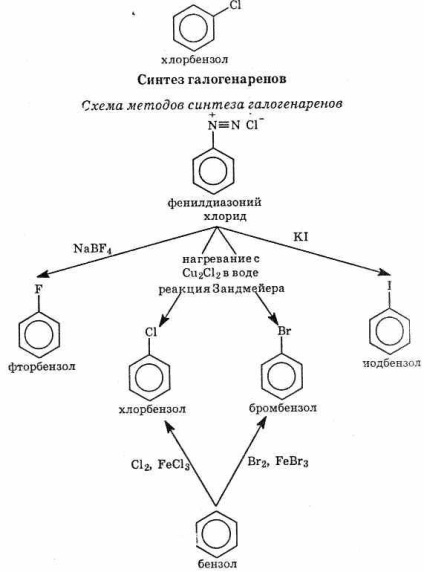
Хімічні властивості галогенаренов
Галогенарени значно менше реакционноспособни, ніж галогеналкани. В цьому відношенні галогенарени схожі з галогеналкенамі. Зв'язок C-Г в галогенаренах значно міцніше,
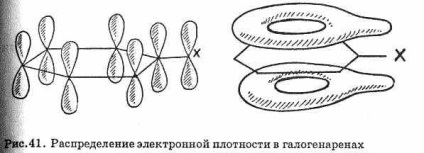
ніж в галогеналканами, за рахунок перекривання р-орбіталей атома галогену з -орбиталями бензольного кільця (рис. 41), що приво-дит до збільшення міцності зв'язку вуглець-галоген і ускладнює реакції заміщення галогену.
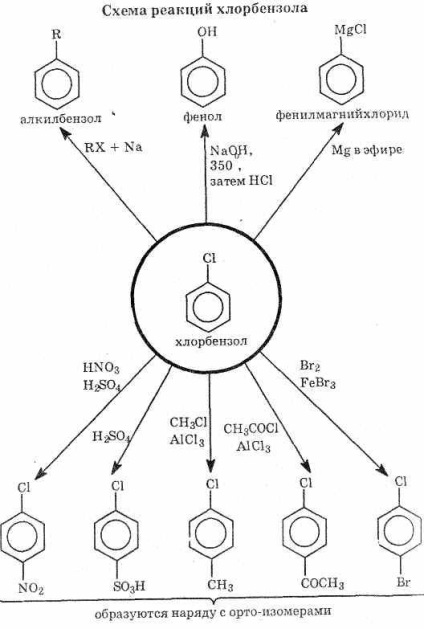
Відомі два типи реакцій галогенаренов: заміщення галогену і заміщення в бензольному кільці (див. Схему).
^ Заміщення атома галогену
1. Гідроліз галогенаренов йде тільки в жорстких умовах. Прикладом може служити синтез фенолу С6 Н5 ОН з хлорбензолу. У промисловості фенол отримують нагріванням хлорбензолу з гідроксидом натрію до 350 ° С при 150 ат. Утворений фенолят натрію перетворюють в фенол дією розведеної кислоти:
2. Галоген може бути заміщений на вуглеводневий радикал: I C6 H5 Br C2 H5 Br 2NaС6 Н5 С2 Н5 2NaBr
^ Заміщення в бензольному кільці
I Галогенарени менш реакційноздатні, ніж бензол. Вони вступають у звичайні реакції, характерні для бензольного кільця, в тому числі в реакції заміщення. Атом галогену відтягує електрони з бензольного кільця, дезактівіруя його, але є орто-, пара-орієнтанти (див. §3.3).
У табл. 37 порівнюються властивості галогеналканов і гало-генаренов.