Кількість ниркових артерій, неідентичність групи крові донора і реципієнта не вплинули на частоту розвитку ОКН пересадженою нирки.
Протягом перших 3-х місяців після трансплантації гостре відторгнення зафіксовано в 46 спостереженнях (18,4%). Більшість кризів було підтверджено морфологічно (36 з 46, що склало 78,2%). Десять епізодів гострого відторгнення діагностовані на підставі клінічних та лабораторно-інструментальних методів дослідження (скорочення діурезу, підвищення креатиніну сироватки, зниження кровотоку і підвищення периферичного опору при доплеровском моніторування та ін.).
Аналіз факторів, здатних вплинути на розвиток гострого відторгнення продемонстрував його тісний зв'язок з наявністю ОКС (р = 0,001; 95% ДІ) (рисунок 17), призначенням індукційної терапії анти-CD25 + антитілами (р = 0,006) і призначенням азатіоприну в складі стартовою імуносупресивної терапії (р = 0,007).
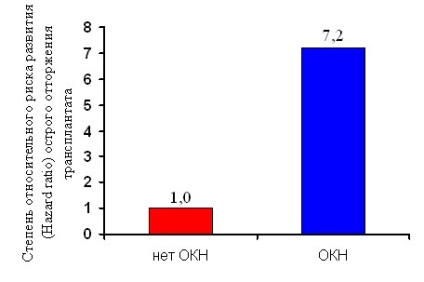
Малюнок 17. Розподіл епізодів гострого відторгнення в залежності від наявності ОКС (р = 0,0001).
Вплив досліджуваних факторів, здатних корелювати з розвитком відторгнення, представлені в таблиці 12.
Значення відносного ризику впливу окремих факторів на виникнення гострого відторгнення трансплантата при 95% довірчому інтервалі
Ускладнення у донорів нирки і віддалені наслідки нефректомії.
Найбільш частим хірургічним ускладненням у донорів стало формування гематоми або сірому в підшкірній жировій клітковині - 19 випадків (7,6%) (таблиця 13). У 12 спостереженнях це зажадало відкритого ведення рани. Кровотеча з ложа видаленої нирки, розвинене в перші години після нефректомії спостерігалося у двох донорів (0,8%). В обох випадках це послужило причиною проведення повторних оперативних втручань. У 9-ти донорів зі сформованою гематомою об'ємом від 100 до 500 мл проводили консервативну терапію.
Невисока частота хірургічних ускладнень забезпечується ретельністю проведення гемостазу, а також виконанням загальнохірургічних вимог по догляду за післяопераційної раною. З нехірургіческіх ускладнень найбільш часто спостерігався розвиток ексудативного плевриту з ипсилатеральной по відношенню до нефректомії боку.
ПЕРІОПЕРАЦІЙНОЇ ускладнення у донорів
Гематома в заочеревинному просторі
Поверхневе інфікування рани
Глибоке інфікування рани
Всього повторних операцій
Показники якості життя ЖРД, що відображають фізичний добробут, знижувалися протягом першого року після нефректомії, в подальшому відзначалася тенденція до їх зростання, показники ж емоційного компонента здоров'я відразу після операції демонстрували тенденцію до зростання і перевищення доопераційний значень.
У групі «ідеальних» донорів через 6 років після нефректомії показник систолічного артеріального тиску (САТ) перевищував вихідне значення на 4,6%, в групі пацієнтів, що мають один з факторів ризику - на 5,5% (p> 0,05). Для донорів, що мають комбінацію чинників ризику рівень САТ протягом всього часу статистично значимо відрізнявся від показників інших груп і через 6 років перевищив вихідні значення на 11% (рисунок 18 а). У групі «ідеальних донорів» і донорів з одним фактором ризику показники СКФ демонстрували незначні коливання протягом дослідження, при цьому достовірних відмінностей від вихідного рівня отримано не було (рисунок 18 б). При комбінації чинників ризику значення СКФ через 6 років після нефректомії склало 82,5% від вихідного (p<0,05). По результатам проведенного исследования, ни один донор за весь период наблюдения не нуждался в назначении ЗПТ. Нами не было отмечено случаев снижения уровня почечной функции доноров ниже возрастных физиологических величин. Также не было зафиксировано значимого роста уровня среднего артериального давления после нефрэктомии. Тем не менее, мы считаем, что расширение критериев отбора доноров для родственной трансплантации почки является одним из перспективных направлений решения проблемы дефицита органов. Доноры, к которым были применены расширенные критерии отбора, демонстрировали некоторое снижение почечной функции, не достигающее клинически значимого уровня. Любое сочетание факторов риска должно рассматриваться как противопоказание к нефрэктомии с точки зрения безопасности донора, даже при хорошем функциональном прогнозе трансплантации у реципиента.
Малюнок 18. Динаміка САД і СКФ в післяопераційному періоді.
Хірургічні ускладнення у реципієнтів.
У семи реципієнтів (2,8%) в найближчу добу після трансплантації була проведена ревізія операційної рани в зв'язку з розвиненим гострим кровотечею. У одного пацієнта повторне оперативне втручання було пов'язане з виниклим кровотечею після виконання діагностичної біопсії пункції. Ускладнення з боку сечовивідної системи були зафіксовані у 13 (5,2%) реципієнтів. У п'яти пацієнтів проведені повторні операції в найближчі терміни після трансплантації в зв'язку з неспроможністю уретероцістоанастомоза. Некроз дистального відділу сечоводу протягом першого місяця після операції зафіксовано у шести хворих. Одним із заходів профілактики останнього ускладнення слід вважати залишення максимально короткого сечоводу довжиною, необхідною для його прямого ходу від трансплантата до сечового міхура. Хірургічні ускладнення у реципієнтів представлені в таблиці 14.
Хірургічні ускладнення у реципієнтів ниркового трансплантата
Виживання трансплантатів та реципієнтів.
За час дослідження втрачений 21 трансплантат, що склало 8,4%. Хронічна трансплантаційна нефропатія викликала втрату функції 16 пересаджених нирок, що склало 76,2% від усіх втрат. Один трансплантат, що не відновив функцію, був віднесений до первинно-, що не функціонує. З усіх 16 трансплантатів, втрачених внаслідок хронічної трансплантаційної нефропатії, в 11 випадках було зафіксовано недотримання режимів терапії. Причини втрат трансплантатів перераховані в таблиці 15.
Причини втрати функції трансплантата
Число випадків,% від втрат