Афінаж - очищення благородних металів від домішок і їх поділ у нас проводять на централізованих заводах, що мають обладнання та умови для проведення необхідних переділів з малими втратами.
На афінажні заводи надходить шляхових і самородне золото, виділене при гравітаційному збагаченні руд і розсипів, золото з амальгам, метал дорі з шламів від електролізу міді і відходів, виробництва свинцю. Тут же переробляють виробничий і побутовий брухт, стару монету, сплави, отримані з вторинної сировини, і інші матеріали.
Крім золота і срібла, масове відношення яких буває дуже різним, в сировину зустрічаються платинові метали, а також мідь, свинець, сурма, залізо, олово, вісмут і інші домішки.
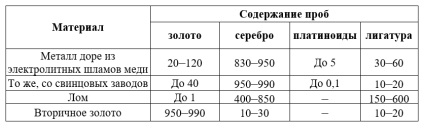
Окремі партії сировини часто малі по масі і неоднорідні, тому для усереднення і уточнення розрахунків з постачальниками застосовують приймальню плавку в індукційних печах і випробують отримані злитки.
Щоб відокремити лігатуру і основну масу срібла, рідкі сплави в таких же печах в тиглях з графіту продувають хлором. Всі метали хлорують, хлориди возгоняются, але головним чином розчиняються в шлаку, для первинного утворення якого завантажують буру, соду і пісок. За наведеними нижче даними про ізобарних потенціалах освіти хлоридів при 1200 ° С і температурах їх кипіння можна орієнтовно судити про хід хлорування:
Спочатку возгоняются і переходять в шлак хлориди елементів лігатури, потім AgCl і, нарешті, АuCl3. При першій появі ознак хлорування золота продування припиняють, метал 995 проби розливають у виливниці і здають в валютний фонд або додатково очищають електролізом, як описано нижче. Останнє завжди необхідно при утриманні платиноїдів.
Хлорідний шлак складається в основному з AgCl і CuCl, його подрібнюють, завантажують в мішки, які потім розміщують у ванні з розбавленою сірчаною кислотою разом з листами заліза. Срібло при цьому відновлюється іонами Fe 2+:
AgCl + Fe 2+ = Ag + Fe 3+ + Сl,
хлорид міді окислюється
CuCl + Fe 3+ = Cu 2+ + Fe 2+ + Сl.
Проникаючи через тканину мішків, Cu 2+ цементуються залізом. Іони Fe 3+ також відновлюються залізом, тому в розчині їх дуже мало і рівновагу реакції відновлення срібла залізом зрушено вправо. Досить повне відновлення срібла досягається за дві доби при температурі розчину 90-100 ° С.
Осад цементного срібла пресують, плавлять і відливають у аноди по 10 кг у вигляді плит товщиною близько 10 мм, в них не повинно бути більше 200 проб золота і 75 проб лігатури.
електроліз срібла
Електролітом служить розчин AgNO3 з активністю 1 моль / л (до 100 г / л Ag).
При розчиненні анодів в розчин переходять срібло, мідь, свинець, вісмут і інші домішки. Золото випадає у вигляді порошкоподібного шламу, що містить платинові метали, селен, телур, сірку і інші нерозчинні в електроліті домішки.
Катодні основи роблять з тонких листів срібла або алюмінію.
Катодний осад срібла має пухку крупнокристалічного структуру; він легко зчищається з катодного основи і падає на дно ванни. Для того щоб осад чистого срібла і золотий шлам не змішувалися, аноди поміщають в мішки з тканини.
Аноди товщиною близько 10 мм розчиняються приблизно протягом доби, після чого нерозчинений залишок повертають на плавку, з анодних чохлів вивантажують золотий шлам, а з дна ванни алюмінієвими дірчастими черпаками витягають кристали чистого срібла.
щільність струму не повинна перевищувати 400-600 А / м 2. електроліт необхідно енергійно перемішувати і не допускати в ньому значне накопичення домішок, головним чином міді, якої щоб уникнути забруднення катодного осаду повинно бути в розчині не більш 4-5%.
Якщо золота більше 200 проб, воно пасивує аноди і починається виділення кисню, а напруга на ванні відповідно підвищується.
Ванни ємністю до 0,6 м 3 роблять з вініпласту і зміцнюють дерев'яними або залізними каркасами. Температура електроліту близько 40 ° С підтримується за рахунок тепла, що виділяється струмом. Для перемішування розчин перемішують повітрям. Напруга на ванні в залежності від складу електроліту і щільності струму 0,8-2,6 В, витрата енергії 300-600 кВт • год / т.
Осад срібла після промивання розведеною азотною кислотою, водою і переплавки має чистоту 999,9 проб. Для окремих споживачів повторним електролізом отримують метал 999,99 або 999,999 проби.
Відпрацьований електроліт збіднюють сріблом в окремих ваннах з анодами з низькопробних сплавів.
електроліз золота
На електроліз надходить метал після хлорування і шлами від електролізу срібла, попередньо піддані многостадийной хімічному очищенню. Все це плавлять в індукційних печах і відливають у прямокутні аноди масою по 2-3 кг. Аноди забруднені сріблом, платиновими металами і порівняно мало - лигатурой.
Електролітом служить розчин НАuСl4 і НСl (до 200 г / л Аu і 80 г / л НСl). Золото розчиняється по реакціях:
Аu + 4Сl - - 3е = АuСl - 4; Е ° = 0,93 В,
Аu + 2Сl - - е = АuСl - 2; Е ° = 1,11 В.
Поява іонів АuСl - 2 можливо через концентраційної поляризації при високій щільності струму, або внаслідок утворення на аноді кірки AgCl; однак вони негайно доспропорціоніруются з виділенням осаду металу, що випадає в шлам:
При недостатній кислотності і температурі золоті аноди пасивуються, розчинення їх припиняється, і починається виділення хлору
Кисень ж не виділяється внаслідок перенапруги його на золоті.
Електроліз проводять при 50-60 ° С. Платина і паладій розчиняються і накопичуються в електроліті:
Pd + 4Сl - - 2е = PtCl 2 4; E ° = 0,62 В.
Складові лігатури: мідь, свинець, вісмут, залізо, олово, сурма та інші метали утворюють прості іони або комплексні хлориди, труднощі розчинення анода вони зазвичай не викликають. Залізо, що переходить в розчин у вигляді Fe 2+. відновлює золото, збільшуючи перехід його в шлам:
АuСl - 4 + 3Fe 2+ = Аu + 3Fe 3+ + 4Cl -.
Срібло дає нерозчинний хлорид.
Якщо в сплаві менше 50 проб срібла, хлорид його ускладнень не викликає. При більшому вмісті AgCl покриває анод міцної більш-менш щільною кіркою, перешкоджаючи розчиненню золота.
За способом Вольвіля вдається розчиняти золоті аноди, в яких буває до 200 проб срібла, застосовуючи асиметричний струм. Для цього разом з постійним - через ванну пропускають приблизно рівний йому за силою змінний струм.
Вірогідність забруднення катодного осаду домішками невелика; проте осадження разом із золотом платини і паладію можливо, особливо при високій щільності струму. Уникаючи цього, не допускають підвищення концентрації платини більше 50 г / л, а паладію більше 15 г / л. Інших домішок в розчині, що містить не менше 100 г / л золота, не повинно бути більше Сu 90 г / л; Рb 1,5 г / л; Ті 4 г / л і 2% Fe.
Відпрацьований електроліт збіднюють по золоту в окремих ваннах з графітовими анодами, після чого різними способами виділяють з нього залишки золота і платиноїди.
Електроліз золота проводять в фарфорових рідше в вініпластові ваннах ємністю 25 л. Аноди загальним числом, наприклад 15, підвішують на срібних штангах по три в ряд, проти кожного ряду поміщають один загальний катод з рифленою золотої фольги товщиною 0,2 мм. Ванни встановлюють в водяні лазні, електроліт перемішують повітрям.
Сумарна щільність постійного і змінного струму досягає 1500 А / м 2. напруга на ванні близько 1 В. Чистота катодного осаду після механічного очищення щітками, а потім промивання соляною кислотою і аміаком 999,9 проб.