Альдегіди і кетони об'єднують загальною назвою карбонілсодержащіе або карбонільні сполуки. У кетонах до карбонільної групі приєднані два вуглеводневих залишку, а в альдегідах один з них водень. У формальдегіді до карбонільної групі приєднані два атома водню.
кетони альдегіди формальдегід
При називання альдегидная група може розглядатися і як заступник:
бензолкарб - циклогексан - 2-Нафталін-
альдегід карбальдегід карбальдегід
4-метаноілбензойная кислота 4-етаноілбензолсульфокіслота
(П-формілбензойная кислота) (п-ацетілбензолсульфокіслота)
За винятком газоподібного формальдегіду, нижчі альдегіди і кетони є рухливі рідини. Температури кипіння альдегідів і кетонів нижче температур кипіння спиртів з тим же числом атомів вуглецю, так як карбонільні сполуки самі по собі водневих зв'язків не утворюють. Нижчі альдегіди і кетони розчинні у воді, мабуть, за рахунок утворення водневих зв'язків:
Багато методи отримання альдегідів і кетонів подібні, але існує і ряд особливих способів, придатних для синтезу тільки альдегідів або тільки кетонів.
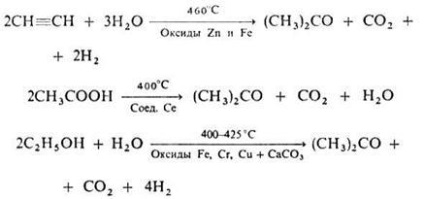
Найпростіший альдегід - формальдегід - можна отримувати окисленням метану киснем повітря в присутності мідно-цинкового каталізатора:
Окисленням толуолу може бути отриманий бензальдегід. Найбільш перспективно окислення киснем повітря в присутності каталізатора (наприклад, V2O5):
Ацетофенон проводиться в промисловості каталітичним окисленням етилбензолу киснем повітря:
В якості окислювача іноді використовують сірчану кислоту. Так, обробка адамантана концентрованої сірчаної кислотою при 75 оС протягом 5 год з виходом 50-60% дає адамантанон:
Окислення етилену в присутності хлоридів паладію (II) і міді (II) призводить до утворення ацетальдегіду (Вакер-процес):
При окисленні етилену киснем у присутності триоксида молібдену і фосфорної кислоти спочатку утворюється окис етилену, але вона негайно изомеризуется в оцтовий альдегід. Для зменшення часу контакту, і запобігання подальшого окислення ацетальдегіду одночасно пропускають водяну пару.
Окислення спиртів обговорювалося в розділі 12.2.5. Окисленням метанолу одержують формальдегід
Важливий розчинник метилетилкетон отримують в промисловості окисленням 2-бутанолу.
У лабораторних же умовах в якості окислювача використовується біхромат калію або натрію в кислому середовищі. Окислювачем в цьому випадку є хромова кислота. Наприклад, реакція
проходить за наступним механізмом:
Альдегіди можуть бути отримані з первинних спиртів шляхом їх окислення пірідінійхлорхроматом (ПХХ):
Упр.1. Напишіть реакцію отримання гептаналя з 1-гептанол.
Упр.2. Напишіть реакції, що лежать в основі промислових методів отримання (а) формальдегіду, (б) ацетальдегіду, (в) бензальдегіду, (г) ацетону, (д) ацетофенону?
Упр.3. Запропонуйте схему отримання формальдегіду з СО і Н2.
Гідроформілірованіе алкенов (оксосинтезом)
При температурі від 30 до 250 ° С і тиску 100-400 атм у присутності дікобальтоктакарбоніла алкени приєднують водень і монооксид вуглецю з утворенням альдегідів. Зазвичай виходить суміш ізомерів:
Піроліз солей карбонових кислот.
При нагріванні барієвих або кальцієвих солей карбонових кислот утворюються кетони. Саме так вперше був отриманий ацетон:
З дикарбонових кислот> С6 і вище отримують циклічні кетони:
Упр.4. Напишіть реакції одержання (а) ацетону, (б) діетілкетона і
(В) ціклопентанона пиролизом барієвих солей відповідних кислот.
Арени форміліруют сумішшю СО і HCl в присутності хлоридів алюмінію і міді (I):
Ця реакція є варіантом ацилирования, так як суміш CO і HCl можна уявити собі як нестійкий хлорангидрид мурашиної кислоти:
Роль CuCl полягає в первісному освіту комплексу з СО, що підвищує його концентрацію в реакційній суміші.
Феноли і прості ефіри, а також нітробензол і все з'єднання з електро-ноакцепторнимі заступниками в реакцію Гаттермана-Коха не вступають.
Упр.5. Напишіть схеми одержання по реакції Фріделя-Крафтса:
(А) пропіофенона; (Б) бутирофенона; (В) бензофенону.
Упр.6. Напишіть схеми одержання ацетофенону: (а) окисленням вуглеводні-роду, (б) окисленням спирту, (в) гідролізом дігалогенуглеводорода, (г) ацилуючий-ням бензолу.
Відновлення похідних карбонових кислот
Альдегіди можна отримувати відновленням похідних карбонових кислот. Хлорангидріди кислот можуть бути перетворені в альдегіди відновленням воднем в присутності паладію, нанесеного на сульфат барію. Каталізатор дезактивують добавками хіноліну з сіркою або тіомочевиною.
У сучасних методах як відновників використовують різні комплексні гідриди металів. Одним з кращих відновників служить трис (трет-бутокси) гідроалюмінати літію, що утворюється при взаємодії алюмогідріда літію з трет-бутиловим спиртом.
Ефіри й нітрили карбонових кислот відновлюються в альдегіди за допомогою діізобутілалюмінійгідріда.
Тріс (трет-бутокси) гідроалюмінати літію Діізобутілалюмінійгідрід
Ефіри й нітрили карбонових кислот відновлюються в альдегіди за допомогою діізобутілалюмінійгідріда.
Літійдіалкілкупратний метод отримання кетонів
При дії літійдіалкілкупрата на хлорангидріди карбонових кислот в ефірі при охолодженні утворюються кетони:
Упр.7. Напишіть реакції, що призводять до наступних перетворень:
(А) бензол ® бромбензол ® фенілмагнійбромід ® бензиловий спирт ® бензальдегід; (Б) толуол ® бензойна кислота ® бензоїлхлориду ® бензальдегід;
(В) етілбромід ® 1-бутин ® 2-бутанон; (Г) 2-бутин ® 2-бутанон; (Д) 1-фенілетанол ® ацетофенон. (Е) бензоїлхлориду ® ацетофенон; (Ж) бензойна кислота ® ацетофенон; (З) бензілбромід ® С6Н5СН2СN ® 1-феніл-2-бутанон;
(І) С6Н5СН2СN ® 2-фенілетаналь: (з) метілкапронат ® гексаналью
В результаті взаємодії альдегідів і кетонів з вуглецевими нуклеофіла-ми утворюються нові зв'язки С¾С. Такими нуклеофилами служать реактиви Гриньяра, литийорганические з'єднання, ацетиленіди і ціановодородная кислота.
А. Приєднання реактивів Гриньяра.
Особлива цінність реактивів Гриньяра полягає в їх здатності створювати нові зв'язки С¾С. Різниця в електронегативності між вуглецем і магнієм (2,5 - 1,2 = 1,3), обумовлює полярність зв'язку між цими атомами і наявність часткового негативного заряду на атомі вуглецю і часткового позитивно-го заряду на атомі магнію. У реакціях реактиви Гриньяра поводяться як карбаніони. Карбаніони є хорошими нуклеофилами і легко приєднуються до карбонільної групі. Магнійорганіческіе з'єднання вступають в реакції нуклеофільного приєднання до альдегідів і кетонів з утворенням алкоксиди, гідролізуються в спирти:
Приєднання до формальдегіду призводить до утворення первинних спиртів.
Інші альдегіди дають вторинні спирти:
З кетонів отримують третинні спирти:
Б. Приєднання литийорганических з'єднань.
Литийорганические з'єднання більш реакційноздатні, ніж магнійлрганічес-кі і забезпечують більший вихід цільового продукту. Онако з ними можна працювати тільки в атмосфері інертного газу. Нижче наводиться приклад використання литийорганических з'єднання для отримання стерически утрудненого третинного спирту.
Феніллітій 3,3-диметил-2-бутанон 3,3-диметил-2-феіл-2-бутанол
В. Приєднання ацетіленід металів
Етінід-аніон також є нуклеофілом. Утворені при цьому спирти містять дві функціональні групи, кожна з яких може бути далі модифікована.
Гідратація отриманого алкінола призводить до утворення a-гідроксікетона, а Гидроборирование-окислення - b-гідроксіальдегіда.
войства виникають речовин необхідно для успішної боротьби з ними. Класифікація полімерів Класифікація полімерів за складом основному ланцюзі макромолекул (найбільш поширена): I. карбоцепні ВМС - основні полімерні ланцюги побудовані тільки з вуглецевих атомів II. Гетероланцюгові ВМС - основні полімерні ланцюги, крім атомів вуглецю, містять гетероатоми (кисень, азот, фосфор, сірку і т.д.).
і, звичайно ж, за багатьма іншими, які будуть отримані, - майбутнє. У цьому напрямку і працюють багато НДІ і дослідники. Аспекти пошуку нових ліків, пошук нових лікарських речовин складається з трьох основних етапів: хімічний синтез, встановлення фармакологічної активності та нешкідливості (токсичності). Така стратегія пошуку з великою витратою часу, реактивів, тварин, праці.
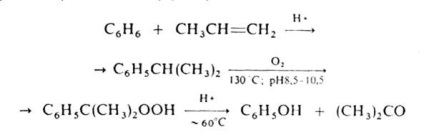
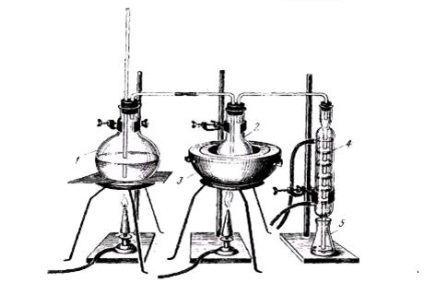
(5), що містить 2 мл 2% розчину їдкого натру; інші дистиляти по 25-50 мл збирають в наступні 1-2 колби, також підготовлені заздалегідь. Для якісного дослідження продукту перегонки з водяною парою в більшості випадків буває досить зібрати 25 мл другого дистиляту. При позитивних результатах реакцій на ту або іншу речовину, що має токсикологічне значення, дистиляцію.
N-метілакрідінія), і осад (5-окси-N-метілакрідан) окислюють хромовим ангідридом. Акрідон сульфируют і нітрит в положення 3 і 3,7, а при бромуванні дає 2,3-дібромпроізводное. Мною апробований метод отримання акрідона з фенілантранілової кислоти. Обрана реакція належить до реакцій замикання циклу. ОГЛЯД ЛІТЕРАТУРИ Реакції замикання циклу. Типи реакцій. Реакції замикання.