Антигени пухлинних клітин. Визначення антигенів пухлинних клітин.
Головним питанням в імунології пухлин є питання про антигени пухлинних клітин. Незважаючи на досить тривалу передісторію, їх молекулярне клонування і ідентифікація знаходяться лише на початку шляху. Причина цього полягає в тому, що лише трохи більше 10 років тому були розроблені методи, що дозволяють виділити з молекул МНС антигенні пептиди, визначити їх первинну структуру і МНС-связиваюшим мотиви, необхідні для зв'язування з різними аллельними формами молекул МНС.
Комплекс цих методів включає в себе руйнування клітин м'якими неіонними детергентами. імуноафінного хроматографію на колонках з іммобілізованими моноклональними антитілами до індивідуальних молекулам МНС, кислотну елюції пептидів з них поділ пептидів методом високоефективної рідинної хроматографії і визначення первинної структури деградацією по Едману або массспектрометріей.
Роботи по ідентифікації МНС-зв'язуючих мотивів для різних алельних форм молекул МНС тривають, і можна сподіватися, що незабаром вони будуть розкриті для більшості алельних форм миші і людини. У пухлинних клітинах виявляється ряд антигенів, які можуть мати клінічне значення в розробці методів імунотерапії раку. Для ідентифікації цих антигенів в останні роки використовують різні підходи. Один з них став можливим після того, як Т-лімфоцити. инфильтрирующие пухлина, навчилися тривалий час культивувати в культурі in vitro, зі збереженням їх специфічності і цитолитических властивостей.
Метод заснований на отриманні експресують бібліотек до ДНК пухлинних клітин в клітинних лініях, що експресують молекули МНС людини, що дозволяє проводити їх скринінг за здатністю викликати цито-токсичну реакцію при додаванні CTL, виділених з пухлин пацієнтів і підтримуваних в культурі in vitro. Наступне за цим визначення первинної структури кодованого продукту дозволяє передбачити найімовірніші послідовності розпізнаються пептидів пухлинного антигену, використовуючи алгоритм, заснований на знанні позицій якірних амінокислотних залишків, що обумовлюють зв'язування пептидів з конкретними аллельними формами молекул МНС.
Одним з найбільш успішних програм цього методу є цикл робіт Террі Буна з співавт. дозволив ідентифікувати кілька груп сперматогональних анігенов.
Унікальні антигени пухлин, які розпізнаються сінгеннимі або аутологічних Т-клітинами
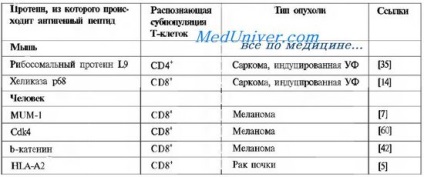
Трансформація і прогресія пухлини можуть супроводжуватися експресією нових антигенів, що стають мішенями імунної атаки організму з появою в крові антитіл до них. Метод, званий SEREX (Serological identification of antigens by recombinant expression cloning), заснований на молекулярному клонуванні антигенів з експресують бібліотек до ДНК пухлинних клітин з використанням антитіл, присутніх в сироватках хворих на рак. Застосування даного методу дозволяє знайти антигени пухлинних клітин, до яких імунна система не володіє толерантністю і здатна відповісти. Ці серологічно визначаються антигени також можуть бути мішенню для CTL.
Як видно з таблиці, ці антигени не належать до якогось одного сімейства. Всі ці антигени в тій чи іншій мірі залучені в процеси канцерогенезу, і мутації визначаються в функціональних ділянках цих білків. Потенційною мішенню Т-клітин можуть також бути продукти мутантного протоонкогена RAS, туморогенну потенціал якого проявляється в результаті активують мутацій. В силу того, що RAS локалізовано всередині клітини, продукція антитіл до його мутантним продуктам не може привести до відторгнення, але мутантні пептиди можуть пре-зентіроваться молекулами МНС класів I і II і розпізнаватися Т-клітинами. Мішенню протипухлинного відповіді також може бути білок, який кодується супресорних геном р53, мутантні продукти якого накопичуються в клітинах через порушення процесів його деградації.
Опухолеспеціфіческіх антигени також можуть утворюватися в результаті внутрішніх делецій або хромосомних транслокацій, в деяких випадках призводять до експресії химерних білків і появи нових амінокислотних замін в точках злиття. Широко відомим прикладом є експресія химерного білка BCR / ABL при деяких лейкемиях
По всій видимості, до групи опухолеспеціфіческіх антигенів можна віднести антигени пухлин, які кодуються генами онкогенних вірусів. Вірус SV-40, віруси поліоми і папіломи людини здатні до випадкової інтеграції в геном клітини, яку вони трансформують. Експресія вірусних білків цих ДНК-вірусів, необхідних для підтримки трансформованого фенотипу пухлинної клітини, обумовлює існування опухолеспеціфіческіх антигенів, які можуть бути мішенями для розпізнавання ци-тотоксіческімі Т-лімфоцитами. На відміну від трансформують продуктів ДНК-містять онковирусов, продукти генів РНК-містять ретровірусів дуже схожі з ендогенними клітинними онкогенами, і тому можуть викликати, в кращому випадку, слабка імунна відповідь.
Незважаючи на те, що опухолеспеціфіческіх антигени є істинними антигенами, ефективність імунної відповіді на які підтверджується широким рядом експериментальних робіт, реальне їх застосування в імунотерапії пухлин в клініці є питанням майбутнього через труднощі ідентифікації таких антигенів у індивідуальних пацієнтів.
Друга велика група олухольассоціірованних антигенів представлена продуктами нормальних немутантів генів пухлинної клітини, експресія яких спостерігається «не в той час і не в тому місці». Ці антигени слабо експресувати в нормальних тканинах, але аберрантним експресувати на трансформованих клітинах. До цих антигенів відносять в себе онкосперматогональние антигени (NY-ESO-1, антигени сім'яників (з сімейств MAGE, GAGE, BAGE), в нормі експресувати в тканинах імунологічно привілейованих зон насінників або плаценти, толерантність до яких є неповною і може бути легко зірвана. У цю групу також можна включити диференціювальні антигени, специфічні для різних гістогенетичних типів або стадій диференціювання клітин (му-ціноподобние антигени, тирозиназа, gplOO, Melan A / MART-1, гангліозиди GD2 і GD3), онкофетальні антигени (СЕА, а-фетопрот еін).
Відносна пухлинна специфічність і доступність цих антигенів розпізнаванню імунною системою може визначатися кількома механізмами:
1) значно більш високим ступенем експресії в пухлинних клітинах у порівнянні з нормальними;
2) більшою доступністю пухлинних клітин, що експресують їх для взаємодії з ефекторними клітинами імунної системи;
3) меншим ступенем глікозилювання в порівнянні з антигенами нормальних клітин, і, внаслідок цього, зростанням доступності епітопів молекул, в нормі «прихованих» вуглеводними ланцюгами (це характерно в разі муцина, що виробляється епітеліальними клітинами);
4) відсутністю експресії молекул МНС на нормальних клітинах, що експресують ці антигени.
Опухольассоціірованние антигени є привабливою мішенню для розробки иммунотерапевтических підходів до лікування раку в зв'язку з тим, що вони з відносно високою частотою зустрічаються на різних типах трансформованих клітин. Проте суттєвою перешкодою для їх використання є те що вони є нормальними антигенами нормальних клітин, і тому імунна система в тій чи іншій мірі толерантна до них. По всій відімості1 ці антигени, подібно до інших нормальним антигенів організму, викликають делецию клонів Т-клітин з високоаффіннимі рецепторами в тимусі. В результаті імунна відповідь на них, як правило, недостатньо ефективний, що виражається у відсутності значних досягнень при спробах їх клінічного використання.