Циклічні пов'язані системи становлять великий інтерес як група сполук з підвищеною термодинамічної стійкістю в порівнянні з сполученими відкритими системами. Ці сполуки мають і іншими особливими властивостями, сукупність яких об'єднують загальним поняттям ароматичность. До них відносяться здатність таких формально ненасичених сполук вступати в реакції заміщення, а не приєднання, стійкість до дії окислювачів і температури.
Типовими представниками ароматичних систем є арени і їх похідні. Особливості електронної будови ароматичних вуглеводнів наочно проявляються в атомно-орбітальної моделі молекули бензолу. Каркас бензолу утворюють шість sp 2 -гібрідізованних атомів вуглецю. Усе # 963;-зв'язку (C-C і C-H) лежать в одній площині. Шість негібрідізованних р-АТ розташовані перпендикулярно площині молекули і паралельно один одному (рис. 3, а). Кожна р-АТ в рівній мірі може перекриватися з двома сусідніми р-АТ. В результаті такого перекриття виникає єдина делокалізованних π-система, найбільша електронна щільність в якій знаходиться над і під площиною # 963; -скелета і охоплює всі атоми вуглецю циклу (див. Рис. 3, б). π-Електронна щільність рівномірно розподілена по всій циклічній системі, що позначається кружком або пунктиром всередині циклу (див. рис. 3, в). Все зв'язку між атомами вуглецю в бензольному кільці мають однакову довжину (0,139 нм), проміжну між довжинами одинарної і подвійний зв'язків.
На підставі квантовомеханических розрахунків встановлено, що для утворення таких стабільних молекул плоска циклічна система повинна містити (4n + 2) π-електронів, де n = 1, 2, 3 і т. Д. (Правило Хюккеля. 1931). З урахуванням цих даних можна конкретизувати поняття «ароматичность».
Ароматичні системи (молекули) - системи, що відповідають критеріям ароматичности:
1) наявність плоского # 963; -скелета, що складається з sp 2 -гібрідізованних атомів;
2) делокализация електронів, що приводить до утворення єдиного π-електрон-ного хмари, що охоплює всі атоми циклу (циклів);
3) відповідність правилу Е. Хюккеля, тобто електронне хмара повинна налічувати 4n + 2 π-електронів, де n = 1,2,3,4 ... (зазвичай цифра вказує на кількість циклів в молекулі);
4) високий ступінь термодинамічної стійкості (висока енергія сполучення).
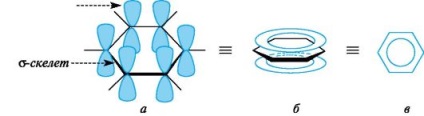
Мал. 3. Атомно-орбітальна модель молекули бензолу (атоми водню опущені; пояснення в тексті)
Стійкість пов'язаних систем. Освіта сполученої і особливо ароматичної системи - енергетично вигідний процес, так як при цьому збільшується ступінь перекривання орбіталей і відбувається делокализация (розосередження) р-електронів. У зв'язку з цим пов'язані і ароматичні системи мають підвищену термодинамічної стійкістю. Вони містять менший запас внутрішньої енергії і в основному стані займають більш низький енергетичний рівень у порівнянні з непарного системами. За різницею цих рівнів можна кількісно оцінити термодинамічну стійкість сполученого з'єднання, т. Е. Його енергію сполучення (енергію делокализации). Для бутадієну-1,3 вона невелика і складає близько 15 кДж / моль. Зі збільшенням довжини сполученої ланцюга енергія сполучення і відповідно термодинамічна стійкість з'єднань зростають. Енергія сполучення для бензолу набагато більше і становить 150 кДж / моль.
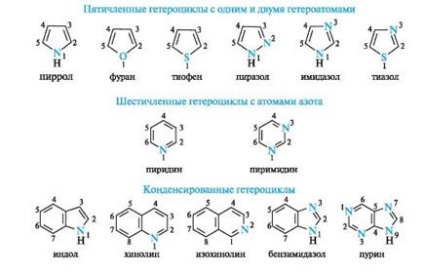
Приклади небензоідних ароматичних з'єднань:
Піридин за електронною будовою нагадує бензол. Всі атоми вуглецю і атом азоту знаходяться в стані sp 2-гібридизації, і все # 963;-зв'язку (C-C, C-N і C-H) лежать в одній площині (рис. 4, а). З трьох гібридних орбіталей атома азоту дві беруть участь в утворенні
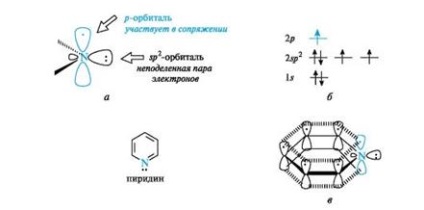
Мал. 4. піридинове атом азоту (а), розподіл електронів по орбіталях (б) і сполучена система в молекулі піридину (в) (зв'язку С-Н для спрощення малюнка опущені)
# 963; -зв'язків з атомами вуглецю (показані тільки осі цих орбіталей), а третя орбиталь містить неподеленную пару електронів і в утворенні зв'язку не бере. Атом азоту з такою електронною конфігурацією називають піридинове.
За рахунок електрона, що знаходиться на негібрідізованной р-орбіталі (див. Рис. 4, б), атом азоту бере участь в утворенні єдиного електронного хмари ср-електрон п'яти атомів вуглецю (див. Рис. 4, в). Таким чином, піридин є π, π-сполученої системою і задовольняє критеріям ароматичности.
В результаті більшої електронегативності порівняно з атомом вуглецю піридиновий атом азоту знижує електронну густину на атомах вуглецю ароматичного кільця, тому системи з піридинове атомом азоту називають π-недостатніми. Крім піридину, прикладом таких систем є пиримидин, що містить два піридинових атома азоту.
Пірол також відноситься до ароматичних сполук. Атоми вуглецю і азоту в ньому, як і в піридині, знаходяться в стані sp2-гібридизації. Однак на відміну від піридину атом азоту в піролі має іншу електронну конфігурацію (рис. 5, а, б).
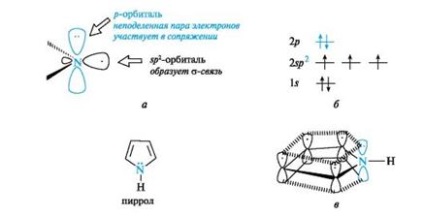
Мал. 5. піррольних атом азоту (а), розподіл електронів по орбіталях (б) і сполучена система в молекулі піролу (в) (зв'язку С-Н для спрощення малюнка опущені)
На негібрідізованной р орбіталі атома азоту знаходиться неподіленої пари електронів. Вона бере участь в сполученні з р -електрона- ми чотирьох атомів вуглецю з утворенням єдиного шестіелектронного хмари (див. Рис. 5, в). Три sp 2 -гібрідние орбіталі утворюють три # 963;-зв'язку - дві з атомами вуглецю, одну з атомом водню. Атом азоту в такому електронному стані отримав назву пиррольного.
Шестіелектронное хмара в піролі завдяки р, п -сопряженію делокалізованних на п'яти атомах циклу, тому пірол є π-надлишкову систему.
У фуранів і тіофенів ароматичний секстет також включає неподеленную пару електронів негібрідізованной p-АТ кисню або сірки відповідно. У імідазолу і піразолу два атома азоту вносять різний внесок в освіту делокалізованних електронного хмари: піррольних атом азоту поставляє пару π-електронів, а піридиновий - один p-електрон.
Ароматичностью володіє також пурин, що представляє собою конденсовану систему двох гетероциклів - піримідину і імідазолу.
Делокалізованних електронну хмару в пуринів включає 8 π-електронів подвійних зв'язків і неподеленную пару електронів атома N = 9. Загальна кількість електронів в сполученні, рівне десяти, відповідає формулі Хюккеля (4n + 2, де п = 2).
Гетероциклічні ароматичні сполуки мають високу термодинамічної стійкістю. Не дивно, що саме вони служать структурними одиницями найважливіших біополімерів - нуклеїнових кислот.