Шизофренія - психічний розлад з надзвичайно високим рівнем втрати працездатності та інвалідизації, лікування якого пов'язане зі значною вартістю і частим персистированием симптомів. Поширеність шизофренії невелика і складає, за різними даними, 0,4-1% протягом життя [1, 2, 3]. Згідно Всесвітньої організації охорони здоров'я (ВООЗ), шизофренія знаходиться на восьмому місці серед причин втрати працездатності у віковій групі 15-44 роки. Додатково до прямих фінансових витрат (втрата працездатності, витрати на лікування) шизофренія лягає важким тягарем також на осіб, які організовують догляд за хворими [4].
типові антипсихотики
Основою терапії шизофренії, як відомо, є застосування типових і атипових антипсихотики (ААП). Перший з типових АП, хлорпромазин, використовувався для анестезії, однак пізніше його властивості відзначили відносно редукції галюцинацій, що послужило приводом для вивчення його антипсихотичних ефектів [6, 7, 8]. Хлорпромазин також володіє седативними властивостями, в зв'язку з чим він отримав позначення як «великий транквілізатор».
На сьогоднішній день існує велика доказова база по використанню типових АП (табл. 1).
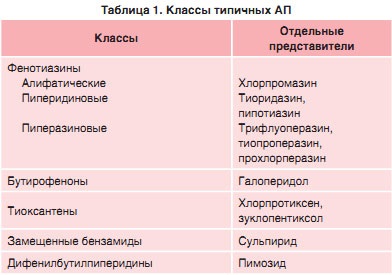
Більша її частина сформувалася в період активного вивчення їх властивостей, починаючи з 60-х рр. ХХ ст. Недавні метааналитические дослідження підтверджують результати цих робіт для окремих препаратів. Так, в Кокранівський систематичний огляд і мета-аналізі, де оцінювали РСІ ефективності тиоридазина в порівнянні з плацебо, були отримані позитивні дані. Цей препарат продемонстрував достовірне поліпшення глобального функціонування у пацієнтів з шизофренією. Ризик оцінки зміни стану учасників як «погіршення» або «відсутність змін» при прийомі тиоридазина був достовірно нижче на 67% (відносний ризик [ВР] 0,33; 95% довірчий інтервал [ДІ] 0,2-0,5). Кількість пацієнтів, яких необхідно було перелічити для досягнення одного додаткового випадку поліпшення стану (NNT), склало 2. Цей препарат також володів седативний ефект (ОР 5,37; 95% ДІ 3,2-9,1). Однак в порівнянні з іншими типовими нейролептиками достовірних відмінностей не виявили. Прийом тиоридазина асоціювався зі змінами на електрокардіограмі (ЕКГ) (ВР 2,38; 95% ДІ 1,66-3,6) [9].
Недавній систематичний огляд і метааналіз по використанню галоперидолу в лікуванні шизофренії та інших психозів продемонстрували, що його прийом був пов'язаний зі зниженням вірогідності відсутності поліпшень після 6 тижнів спостереження в порівнянні з плацебо (ОР 0,67; 95% ДІ 0,58-0,78 ). Крім того, при його прийомі відзначали велику можливість виписки пацієнтів і зниження ризику рецидиву. Однак серед частих побічних ефектів галоперидолу мали місце рухові порушення, такі як паркінсонізм (ОР 5,48), акатизія (ОР 3,66) і гостра дистонія (ОР 11,49) [10].
Незважаючи на велику ефективність типових нейролептиків в порівнянні з плацебо, для багатьох пацієнтів домогтися клінічного ефекту не вдається. Крім того, нерідкі випадки погіршення негативної симптоматики при використанні типових нейролептиків, а також симптомів депресії. Крім іншого, ці препарати можуть надавати несприятливий ефект на когнітивне функціонування і в деяких випадках навіть посилювати когнітивний дефіцит [12, 13].
Що стосується побічних реакцій, найбільш поширеними для цієї групи препаратів щодо ЦНС є гостра дистонія, паркінсонізм і акатизія (табл. 2). Для їх мінімізації часто доводиться призначати антихолинергическое засіб, знижувати дозу препарату або замінювати на ААП.

Щорічна поширеність дискінезії становить близько 5% протягом перших 5 років терапії типовими нейролептиками. За даними досліджень, вона частіше виникає у більш літніх осіб [15]. При цьому прийом класичних нейролептиків асоційований з 10-кратним збільшенням ризику пізньої дискінезії в порівнянні з атиповими [16]. Злоякісний нейролептичний синдром виникає за різними даними приблизно у 0,01-1% пацієнтів, що також набагато вище, ніж при прийомі атипових АП. При цьому найбільшому ризику піддаються ажитированного чоловіки, які отримують внутрішньом'язовіін'єкції з високими дозуванням АП [14]. Крім неврологічних побічних дій типові нейролептики мають і низку інших. Найбільш часто зустрічаються ортостатичнагіпотензія, гіперпролактинемія, сексуальна дисфункція, антихолінергічний ефект, аритмія і підвищення ваги. Лише останній небажаний ефект частіше реєструється при прийомі ААП (табл. 3).
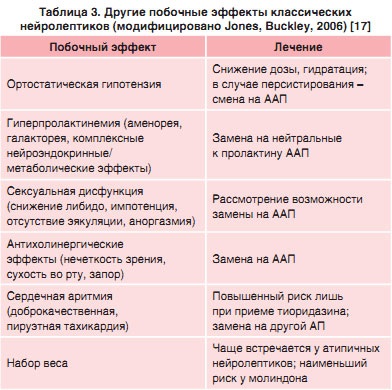
Як відомо, основним механізмом дії нейролептиків є блокада дофамінергічних рецепторів. Однак крім впливу на дофаминергическую нейротрансмісію типові АП впливають на інші нейротрансміттерние системи, зокрема холинергическую, адренергическую, гистаминергическая і серотонінергічну. Вплив на ці системи є субстратом розвитку зазначених побічних реакцій. Так, антихолінергічні побічні явища включають сухість у роті, порушення зору, запор, норадренергические - ортостатична гіпотензія, сексуальні дисфункції, закладеність носа, гістамінергіческіе - седативний ефект [18].
Згідно Британському національному формуляру, що надає релевантну інформацію для практикуючих лікарів щодо раціонального вибору і клінічного використання медичних засобів, фенотіазини в залежності від побічних реакцій можна умовно розділити на три групи. Перша група, що включає хлорпромазин, метотрімепразін і промазин, має виражену седативну дію і помірними антихолинергическими і екстрапірамідними ефектами. Друга група, до якої відносять періціазін, піпотіазін і тіоридазин, характеризується помірною седативною, вираженими антихолинергическими і слабкими екстрапірамідними ефектами. Третя група, що включає флуфеназин, перфеназин, прохлорперазин і трифлуоперазин, має слабку седативну, слабку антихолінергічну і виражене екстрапірамідні дію. Типові нейролептики, що відносяться до інших класифікаційних групах за хімічною будовою, мають побічні ефекти, які можна порівняти з третьою групою фенотиазинов [19].
атипові антипсихотики
Першим синтезованим ААП є клозапін. Початок його використання в 70-х рр. минулого століття продемонструвало кілька суттєвих клінічних відмінностей від інших нейролептиків. Прийом цього препарату був асоційований з відсутністю пізньої дискінезії і підвищення рівня пролактину; при наявності властивостей щодо редукції позитивної симптоматики не викликав загострення моторних порушень у пацієнтів з хворобою Паркінсона; повністю або частково редукував психотичні симптоми більш ніж у половини пацієнтів, що не відповіли на класичні нейролептики; впливав на негативні симптоми; поліпшував когнітивне функціонування при шизофренії, що, зокрема, відноситься до семантичної і іншим видам пам'яті [20].
В основі зазначених клінічних особливостей першого і наступних ААП лежать відмінності в зв'язуванні діючої речовини з дофаміновими і серотонінових рецепторів. Що стосується клозапіну, цей препарат проявляє афінності до рецепторів D1. D2. D3. D4. 5-HT1А. 5-HT1D. 5-HT2A. 5-HT2C. 5-HT6. 5-HT7. a 1. a 2 і мускаринових M1. З них в клінічному плані найбільше значення належить рецепторів D2. D4. 5-HT1А. 5-HT2А. 5-HT2С. a 1 і a 2 [21].
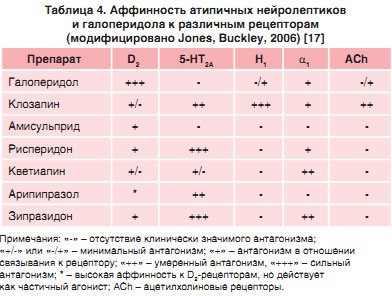
Відповідно до теорії швидкої дисоціації від D2-рецепторів, заснованої на цих даних, подібної швидкої блокади D2-рецепторів досить для антипсихотичної дії. Швидка дисоціація препарату, який використовується в достатніх дозах для блокади рецепторів D2. модулює дофаминергическую систему в ступеня, яка дозволяє відновити нормальне функціонування фізіологічних систем, що і призводить до спостережуваних антипсихотическим ефектів [23].
Крім того, що стосується ступеня зв'язування діючої речовини з D2-рецепторами, вона має велике значення не тільки по відношенню до терапевтичного, але і побічних ефектів [24]. Відомо, що атипові нейролептики поступаються класичним за ступенем зв'язування, але при цьому мають достатню афінність до даних рецепторів для надання антипсихотичної дії. Так, в експериментах показано, що блокада 65-70% стріальних рецепторів асоційована з антипсихотическим ефектом, тоді як понад 80% - зі значним підвищенням ризику екстрапірамідних. Таким чином, вплив на 60-80% D2-рецепторів є найбільш оптимальним терапевтичним вікном для мінімізації ризику неврологічних побічних явищ [23].
Що претендує нині на провідне становище концепція багатофункціональності в психофармакологии може бути використана як науково-методичний базис для розширення клінічних можливостей психотропних засобів. Яскравими показниками багатофункціональності є представники ААП: рисперидон, амісульприд, кветіапін.
5-HT2А
Редукція негативних симптомів, поліпшення когнітивних функцій
D2
Редукція позитивних симптомів, екстрапірамідні побічні ефекти
a 1
Седативну дію, кардіоваскулярні побічні ефекти
Амісульприд
Амісульприд є похідним бензамидов з високою селективністю до антагонізму рецепторів D2 і D3. розташованих в мезолимбической системі (табл. 5). За даними досліджень, ступінь селективності для цих рецепторів є найбільшою серед типових АП і ААП [25]. Така селективність, по видимому, забезпечує більшу антипсихотичні активність в порівнянні з класичними нейролептиками і вплив на негативну симптоматику при шизофренії, а в низьких дозах (50-300 мг) може мати унікальний ефект у пацієнтів тільки з негативними симптомами [26].
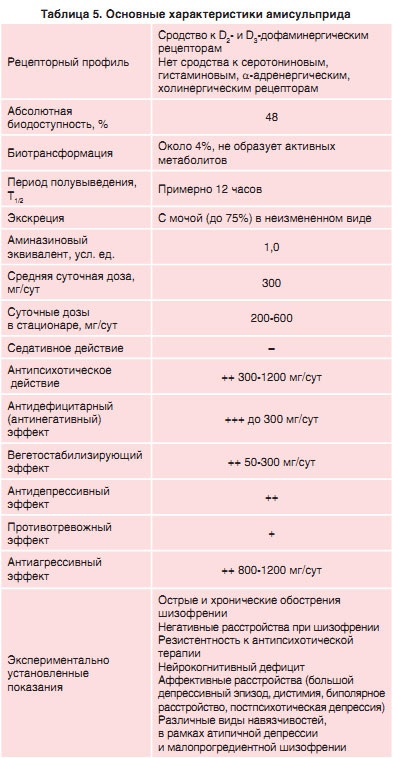
Препарат має подвійну антідофамінергіческім дією: продофамінергіческое блокуючу дію на пресинаптичні ауторецептори найбільш виражено при використанні доз <300 мг/сут и сопровождается активацией лобной коры, антидефицитарным (антинегативным), тимоаналептическим, стимулирующим и вегетостабилизирующим клиническими эффектами.
У більш високих дозах (<1200 мг) амисульприд блокирует постсинаптические субпопуляции D3 -/D2-рецепторов, при этом усиливая дофаминергическую передачу, и оказывает антигаллюцинаторно-антибредовый и антикататонический эффекты. Доказано, что амисульприд демонстрирует более высокую активность в отношении дофаминовых рецепторов лимбических структур и гиппокампальной области по сравнению с рецепторами стриатума, что обеспечивает не только антинегативную и антипсихотическую активность препарата, но и определяет практически полное отсутствие экстрапирамидной симптоматики даже при назначении его в высоких дозировках. Кроме того, в отличие от других ААП, амисульприд не имеет сродства к 5-НТ2 А-серотониновым, a -адренергическим, гистаминовым (Н1) и мускариновым рецепторам, не вызывает каталептических явлений и не обладает выраженным седативным эффектом.
Амісульприд рекомендований в якості пріоритетного засобу для лікування як гострих, так і хронічних форм шизофренії: дані свідчать про його ефективність як щодо позитивної, так і негативної симптоматики при лікуванні хворих, які перебувають в стадії загострення або одержують підтримуючу терапію. Причому ефективність амісульприду перевершує таку у більшості атипових нейролептиків. Крім того, препарат робить позитивний вплив на нейрокогнітівний дефіцит. Він ефективний відносно агресивності, ворожості, тривоги, часто спостерігаються при гострій екзацербаціі шизофренічного психозу, а також при афективних розладах (великий депресивний епізод, дистимия, манія).
Останнім часом в літературі з'явилися згадки про позитивний досвід клінічного застосування амісульприду для терапії пацієнтів з різними видами нав'язливості, кричущих в рамках атипової депресії і малопрогредиентной шизофренії.
Кветіапін демонструє швидке зв'язування з рецепторами D2 при швидкій дисоціації після зв'язування. Малий період зв'язування дозволяє кветіапіном мати найнижчий ризик екстрапірамідних побічних ефектів серед нейролептиків при достатній ефективності [24]. Цей препарат сприяє поліпшенню вербального і вербально-логічного мислення, праксису, нейродинамики, довільної регуляції діяльності. Спочатку він використовувався тільки в якості антипсихотичної і антиманиакальное кошти. Ці властивості кветиапина проявляються при використанні у високих дозах (близько 800 мг), які блокують значне число D2 -дофамінових і 5-НТ2А -серотонінових рецепторів, як і інші відомі ААП.
Одним з кращих прикладів такого підходу до терапії може бути кветіапін, який, як виявилося, при дуже низьких дозах (<25 мг) может применяться в качестве снотворного средства. Гипнотическое действие препарата при использовании низких доз связано с тем, что кветиапин является мощным H1 -антагонистом. Кроме того, как было отмечено выше, промежуточные дозы кветиапина продемонстрировали высокую эффективность в терапии как биполярной, так и униполярной депрессии, что потенциально связано с фармакологическими свойствами активного метаболита препарата, который блокирует NE-транспортер, а также 5-HT2C -рецепторы (рис. 1).

Експериментально встановлені ефективні дози кветіапіну для окремих патологічних станів знаходяться в діапазоні 75-1000 мг / сут (табл. 6, 7).