Яка біологічна роль амінокислот? Спробуємо разом знайти відповідь на це питання. Виявимо особливості будови даного класу органічних речовин, їх хімічні властивості, основні області застосування.
історичні відомості
Першою відкритою амінокислотою був гліцин. Його синтезували в 1820 році шляхом кислотного гідролізу желатину. Розшифрувати амінокислотний склад білкових молекул вдалося тільки до середини минулого століття, саме тоді була виявлена амінокислота - треонін.
Основні функції
На даний момент є інформація про 300 амінокислотах, що виконують в організмі різні функції.
Яка основна біологічна роль амінокислот? Двадцять з них вважають стандартними (протеіногенних), оскільки саме вони входять до складу основних білкових молекул.
Ці сполуки входять до складу певних білків. Оксіпрілін є основою колагену, еластин утворюється десмозіном.
Вони можуть бути проміжними речовинами в обмінних процесах. Таку функцію виконує цитрулін, орнітин.
Біологічна функція амінокислот також складається в синтезі нуклеотидів, поліамідів. Вуглецева ланцюжок цих з'єднань використовується для освіти інших органічних речовин:
- глюкоза синтезується з глюкогенних амінокислот;
- ліпіди утворюються кетогенная сполуками.
Біологічна роль амінокислот полягає в можливості їх використання для визначення функціональних груп. Цистеїн застосовують при виявленні сульфатної групи. Аспарат використовується при виявленні аміногрупи.

особливості номенклатури
Як правильно назвати амінокислоти? Будова, класифікація, біологічна роль цих сполук розглядаються навіть у курсі шкільної програми.
Амінокислоти є похідними карбонових кислот, в складі яких один атом водню заміщується аминогруппой.
Залежно від розташування цієї функціональної групи, в однієї сполуки може існувати кілька ізомерів. Хіміки використовують відразу три різних номенклатури: раціональну, тривіальну, систематичну.
Тривіальні назви даних сполук пов'язані з тим джерелом, з якого вони були виділені. Серін включений до складу натурального шовку, глутамин виявлений в клейковиною злакових рослин. Цистин присутній в каменях сечового міхура.
Раціональне назва пов'язана з похідною карбонової кислоти, а скорочена назва застосовують при вказівці послідовності розташування амінокислот в білковій молекулі. У біохімії користуються скороченими і тривіальними назвами цих сполук.
Класифікація амінокислот
Для того щоб зрозуміти, яка біологічна роль амінокислот і їх застосування, зупинимося докладніше на видах класифікації цих органічних сполук.
В даний час використовується кілька видів класифікації:
- по радикалу;
- за ступенем його полярності;
- за варіантом синтезу в організмі.
За будовою радикала в органічній хімії виділяють різні види амінокислот.
Аліфатичні сполуки можуть містити по одній карбоксильної і аміногрупи, в такому випадку вони є моноамінокарбоновимі сполуками.
При наявності двох СООН і однієї аміногрупи речовини називають моноамінодікарбоновимі речовинами.
Також виділяють діаміномонокарбоновие і діамінодікарбоновие форми амінокислот.
Циклічні види відрізняються не тільки кількістю циклів, але і їх якісним складом.
За Ленинджер, амінокислоти поділяють на чотири групи за особливостями взаємодії вуглеводневої радикала з водою:
- гідрофобні;
- гідрофільні;
- негативно - заряджені;
- позитивно-заряджені.
Залежно від здатності амінокислот синтезуватися в людському організмі виділяють незамінні (надходять з їжею), а також замінні види.
Численними науковими експериментами була доведена біологічна роль альфа-амінокислот.
Фізичні властивості
Чим характеризуються амінокислоти? Номенклатура, властивості, біологічна роль цих сполук пропонується випускникам шкіл на єдиному державному іспиті з хімії. Ці органічні кислоти добре розчиняються у воді, володіють високою точкою плавлення.
Їх оптична активність пояснюється присутністю в молекулах асиметричного вуглецевого атома (винятком є лише гліцин). Саме тому були виявлені L- і D-стереоізомери амінокислот.
Ізомери L-ряду виявлені в складі білків тварин. Величина водневого показника для цих сполук знаходиться в діапазоні 5,5-7.
Хімічні властивості
Розглянемо докладніше амінокислоти. Будова, хімічні властивості, біологічна роль цих органічних речовин необхідно знати.
Специфіка хімічних властивостей амінокислот полягає в їх подвійності. Причиною амфотерности є наявність двох функціональних груп в складі цих органічних кислот.
Присутність карбоксильної групи СООН надає цим з'єднанням кислотний характер. Вони легко вступають у взаємодію з активними металами, основними оксидами, лугами. Також кислотність властивостей цих органічних сполук проявляється в реакції етерифікації (зі спиртами утворюють ефіри).
Амінокислоти можуть також вступати в хімічну взаємодію з солями, утвореними слабкими мінеральними кислотами. Як приклад такої реакції можна розглядати взаємодію амінокислот з гідрокарбонатами і карбонатами.
Основні властивості даного класу полягають в здатності амінокислот реагувати з іншими кислотами по аминогруппе. При цьому утворюються солі.
Біологічна роль декарбоксилирования амінокислот в тому, що утворюється нейтральне середовище, яка абсолютно безпечна для живого організму.
Нінгідринова реакція дозволяє виявляти в розчині амінокислот. Суть реакції полягає в тому, що безбарвний розчин нингидрина при взаємодії з амінокислотою, буде конденсуватися в формі димера через атом азоту, який відщеплюється від аміногрупи відповідної кислоти.
Одержуваний пігмент має червоно-філолетовий відтінок, крім того, відбувається декарбоксилювання амінокислоти, в результаті якого утворюється певний альдегід і оксид вуглецю (4).
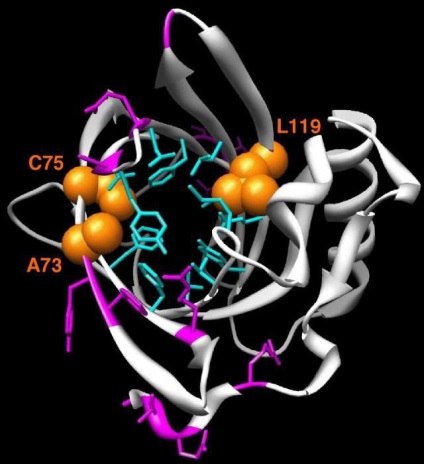
специфічні реакції
У амінокислотах, крім карбоксильної і аміногрупи, можуть міститися додаткові функціональні групи. Для їх визначення в науково-дослідних лабораторіях проводять якісні реакції.
Аргінін можна виявити в суміші шляхом здійснення якісної реакції Сакагучи (на гуанідинового групу). Цистеїн можна визначити методом Фоля, специфічним для SH-групи.
Реакція нітрування (ксантопротеїнова реакція) дає можливість підтверджувати присутність в суміші ароматичної амінокислоти. Реакція Миллона призначена для виявлення гідроксильної групи в ароматичному кільці тирозину.
Особливості пептидного зв'язку
Чим характеризуються сірковмісні амінокислоти? Їх біологічна роль пов'язана з утворенням молекул пептидів. При взаємодії між собою декількох молекул амінокислот, відбувається відщеплення молекул води, а залишки амінокислот за допомогою пептидного (амидной) зв'язку утворюють пептиди.
Число амінокислотних залишків, що утворюють поліпептид, істотно варіюється. Ті пептиди, які містять не більше десяти амінокислотних залишків, називають олигопептидами. У назві утворюється з'єднання часто вказують кількість амінокислотних залишків.
Якщо в складі речовини міститься більше десяти амінокислотних залишків, з'єднання називають поліпептидами. Для тих з'єднань, в складі яких більше п'ятдесяти залишків амінокислот, продукт їх синтезу називають білком.
Так, гормон ГлюкаГен, в складі якого є 29 амінокислот, біологи називають гормоном. Амінокислотними залишками вважають мономери вихідних органічних кислот, з яких утворюються білкові сполуки.
Той залишок амінокислоти, який записується зліва, має аміногрупу, називають N-кінцевим, фрагмент, що володіє карбоксильною групою, вважають С-кінцевим, його прийнято записувати справа.
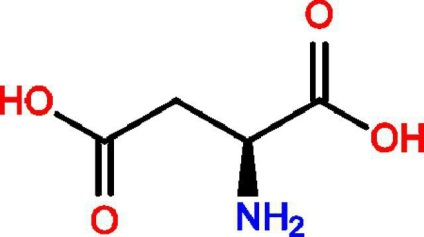
Значимість деяких амінокислот
Гліцин (амінооцтова кислота) є донором вуглецевих фрагментів, які потрібні для утворення гемоглобіну, пиррола, холіну, нуклеотидів, а також для синтезу креатину.
Серін присутній в складі активних центрів ферментів. Ця амінокислота потрібна для процесу синтезу Фосфопротеіни (казеїну натурального молока).
Глюкогенних кислота потрібна для формування вторинної, третинної структури білкової молекули. У цьому з'єднанні є сама реакційно-активна функціональна група, тому речовина легко вступає в окислювально-відновні процеси, пов'язує важкі метали у вигляді нерозчинних сполук. Саме вона виконує функцію донора сульфатної групи, затребуваною для синтезу сірковмісних речовин.
висновок
Амінокислоти є амфотерними органічними сполуками, що мають важливе біологічне значення. Саме амінокислотні залишки в процесі синтезу утворюють послідовність, яка є первинною структурою білкової молекул. Залежно від того, як саме вишикуються амінокислотні фрагменти, синтезується білок, специфічний для кожного живого організму.

Список найдорожчих особняків США очолив будинок за 250 млн доларів Нещодавно збудований особняк Бель Ейр був виставлений на продаж за 250 млн $, що зробило його найдорожчим будинком, продаваним на даний момент в США.

10 божевільних збігів, в які важко повірити У житті кожної людини траплялися якісь збіги. Буває, що ви думаєте про одного, якого не бачили вже багато років, і тут же несподівано його вбуд.
