З усіх поширених рідин вода - найбільш універсальний розчинник, рідина з максимальними величинами поверхневого натягу, діелектричної постійної, теплоти пароутворення і найвищої (після аміаку) теплотою плавлення. На відміну від більшості речовин вода, замерзаючи при низькому тиску, розширюється.
Ці специфічні властивості води пов'язані з особливою будовою її молекули. Хімічна формула води Н2 0 оманливе проста. У молекулі води ядра атомів водню розташовані несиметрично стосовно ядру атома кисню і електронів. Якщо атом кисню знаходиться в центрі тетраедра, центри мас двох атомів водню будуть в кутах тетраедра, а центри зарядів двох пар електронів займуть два інших кута (рис.1.1). Таким чином, чотири електрона розташовуються на можливо найбільшій відстані як від ядра атома кисню, так і від ядер атомів водню, при якому вони ще притягуються ядром атома кисню. Інші шість електронів молекули води розташовані так: чотири електрона знаходяться в положенні, що забезпечує хімічний зв'язок між ядрами атомів кисню і водню, а два інших розташовані поблизу ядра атома кисню.
Асиметричне розташування атомів молекули води обумовлює нерівномірний розподіл електричних зарядів в ній, що робить молекулу води полярної. Така будова молекули води обумовлює тяжіння молекул води один до одного в результаті утворення між ними водневих зв'язків. Розташування атомів водню і кисню, всередині утворилися агрегатів молекул води схоже з розстановкою атомів кремнію і кисню в кварці. Це відноситься до льоду і в меншій мірі до рідкої воді, агрегати молекул якої завжди знаходяться в стадії перерозподілу. При охолодженні води її молекули групуються в агрегати, які поступово збільшуються і стають все більш стійкими в міру наближення до температури 4 ° С, коли вода досягає максимальної щільності. При цій температурі вода ще не має жорсткої структури і поряд з довгими ланцюжками її молекул існує велика кількість окремих молекул води. При подальшому охолодженні ланцюжка молекул води ростуть за рахунок приєднання до них вільних молекул, в результаті чого щільність води зменшується. Коли вода перетвориться на лід, все її молекули входять в більш-менш жорстку структуру в вигляді незамкнутих ланцюжків, що утворюють кристали.
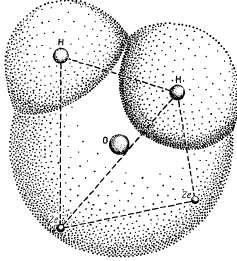
Взаємне проникнення атомів водню і кисню. Ядра двох атомів водню і дві пари електронів перебувають в кутах тетраедра: у центрі розташоване ядро атома кисню.
Високі величини поверхневого натягу і теплоти пароутворення води пояснюються тим, що для відділення молекули води від групи молекул потрібно відносно велика витрата енергії. Прагнення молекул води встановлювати водневі зв'язку та їх полярність пояснюють незвично високу розчиняють здатність води. Деякі сполуки, такі, як цукру і спирти, утримуються в розчині завдяки водневим зв'язкам. Сполуки, які мають високий ступінь іонізації введенні, наприклад хлористий натрій, утримуються в розчині внаслідок того, що іони з протилежними зарядами нейтралізуються групами орієнтованих молекул води.
Молекула води H2 Про побудована у вигляді трикутника: кут між двома зв'язками кисень - водень 104 градуси. Але оскільки обидва водневих атома розташовані по одну сторону від кисню, електричні заряди в ній розосереджуються. Молекула води полярна, що є причиною особливого взаємодії між різними її молекулами.
Атоми водню в молекулі H2 О, маючи позитивний частковий заряд, взаємодіють з електронами атомів кисню сусідніх молекул. Така хімічна зв'язок називається водневої. Вона об'єднує молекули H2 Про в своєрідні полімери просторової будови; площину, в якій розташовані водневі зв'язку, перпендикулярні площині атомів тієї ж молекули H2 О. Взаємодією між молекулами води і пояснюються в першу чергу незакономерно високі температури її плавлення і кипіння. Потрібно підвести додаткову енергію, щоб розхитати, а потім зруйнувати водневі зв'язку. І енергія ця дуже значна. Ось чому така велика теплоємність води.
Як і більшість речовин, вода складається з молекул, а останні з атомів.
Структура атома наступна: навколо позитивно зарядженого протонного ядра на певних рівнях за різними орбітах рухаються негативно заряджені електрони, що утворюють електронне хмара. Число електронів в кожній оболонці для атома кожного елемента чітко визначений. Так, у атома водню лише одна оболонка з єдиним електроном, а у атома кисню дві оболонки: внутрішня з двома електронами і зовнішня з шістьма.
Два атома водню заміщають вакансію двох відсутніх (до восьми) електронів зовнішньої оболонки для її стійкості. Можна було б припускати, що атом кисню і два атоми водню в молекулі води утворюють біля центрального атома кисню кут, близький до 180 °. Однак насправді він значно менше - всього 104 ° 27 '(рис.1.2), що призводить до неповної компенсації внутрішньомолекулярних сил, надлишок яких обумовлює асиметрію розподілу зарядів, що створює полярність молекули води. Ця полярність у води, більш значна, ніж у інших речовин, обумовлює її дипольний момент і діелектричну проникність. Остання у води дуже велика і визначає інтенсивність розчинення водою різних речовин. При 0 ° С діелектрична проникність води (у твердій фазі) становить 74,6; з підвищенням температури вона падає.
Так, при 20 ° С діелектрична проникність води дорівнює 81. Що це означає? Це означає, що два протилежних електричних заряду в воді взаємно притягуються з силою, рівною
1/80 їх взаємодії в повітрі, і що відділення іонів від кристалів будь-якої солі у воді в 80 разів легше, ніж в повітрі.
Численні схеми будови молекули води є гіпотетичними, побудованими на непрямих спостереженнях приладами деяких ознак поведінки і властивостей молекул і атомів. При цьому слід пам'ятати, що ні атоми, ні молекули не мають чітких меж з-за невизначеності як форми, так і точних розмірів орбіт, по яких рухаються електрони, що утворюють по суті справи електронне хмара, залежне від енергетичного стану електрона. Останнє може бути спокійним або збудженим, що залежить, зокрема, і від температури. Звідси різнобій в значеннях обчислених радіусів, а також схематичність гіпотетичних моделей атомів і молекул.