Чи потрібні ембріонам гени?
Є ще одна дивна обставина, що утрудняє розуміння природи індивідуального розвитку тварин. Воно полягає в тому, що ранні етапи онтогенезу, як правило, йдуть взагалі без участі генів, при повністю відключеному геномі.
Замислимося, що це означає. Адже прийнято вважати, що індивідуальний розвиток - це поступова "реалізація" тієї генетичної інформації, яка укладена в геномі заплідненої яйцеклітини (зиготи) і яка в підсумку остаточно "втілюється" в будові дорослого організму. Всі розуміють, що шлях від генотипу до фенотипу важкий і звивистий, але лише деякі еволюціоністи всерйоз намагаються пояснити ключові закономірності еволюції особливостями тих складних процесів самоорганізації, які складають суть онтогенезу (аж надто важка задача). Тому зазвичай проблему намагаються спростити, звівши все до питання про те, яким чином ті чи інші зміни генотипу (наприклад, мутації) можуть відбитися на процесі розвитку зародка.
Геном традиційно розглядається як активний початок (в ньому все "закодовано", він "керує" розвитком). Розвивається зародок, навпаки, вважається чимось на зразок пасивного "результату" діяльності генома. Справа дещо ускладнюється тим, що сам геном в процесі онтогенезу явно не самодостатній: в різних клітинах ембріона одні гени включаються, інші вимикаються в суворій послідовності, яка визначається, зокрема, хімічними сигналами, якими обмінюються між собою клітини і тканини зародка. Хто ким керує, стає не зовсім ясно. Деякі теоретики з цього приводу навіть заявляють, що геном - це не "програма розвитку зародка", а скоріше якийсь набір інструментів, якими зародок користується (або не користується) на свій розсуд.
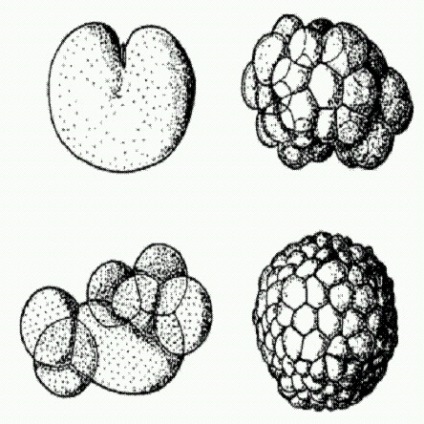
Ділиться яйцеклітина (зліва вгорі), морула у вигляді грудки клітин (зліва внизу), бластула у вигляді порожнього кульки (справа внизу і вгорі). На всіх цих стадіях розвитку тварин геном зазвичай не функціонує. На малюнку - розвиток медузи Aequorea.
Для управління власними генами зародок використовує безліч різних механізмів: це і регуляція транскрипції (зчитування генів) за допомогою малих РНК і спеціальних регуляторних білків - транскрипційних факторів
Ще одна обставина, яка робить сумнівним теза про повну і однозначною зумовленості онтогенезу геномом зиготи, полягає в тому, що, як уже було сказано вище, у переважної більшості тварин на ранніх стадіях розвитку геном взагалі не функціонує. Він просто-напросто відключений, все гени мовчать і матричні РНК ( "зчитуються" з генів матриці для синтезу білка) не виробляються.
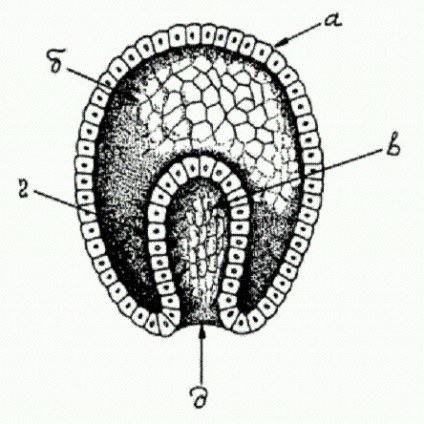
Типова гаструла багатоклітинного тваринного, а - ектодерма (зовнішній зародковий листок), б - бластоцель (первинна порожнина тіла) у в - первинна кишка, г - ентодерми (внутрішній зародковий листок), д - бластопор (первинний рот).
Зародок тим часом зазнає складні перетворення. Яйцеклітина починає дробитися, число клітин ембріона зростає в геометричній прогресії: 2, 4, 8, 16, 32. Нарешті формується одношаровий куля з клітин (бластула). Клітини, що знаходяться на одному з полюсів бластули, мігрують всередину, даючи початок другого зародкового листка (ентодермі), з якої пізніше розвинеться кишечник. На цій стадії двошаровий зародок називається гаструлою. Тільки на цьому етапі у багатьох тварин починають нарешті включатися гени, успадковані від тата з мамою. У інших це відбувається трохи раніше - на стадії бластули. І тільки ссавці - група, унікальна у багатьох відношеннях, - включають свої гени ще раніше (наприклад, миша робить це на стадії двох клітин) (Інша унікальна особливість ссавців - потужний розвиток "геномного імпринтингу", механізму, за допомогою якого батьки цілеспрямовано впливають на спадкові властивості ембріона, частково - в своїх власних корисливих інтересах (див. розділ 8). Цілком можливо, що між цими двома особливостями існує зв'язок. Батьки можуть бути зацікавлені в тому, щоб "відредаговані" ними гени зародка включилися раніше).
Відповідь на перше питання більш-менш ясне. Яйцеклітина містить велику кількість матричних РНК, успадкованих від материнського організму. Ці мРНК зчитуються з материнських генів завчасно, в процесі дозрівання яйцеклітини. Саме вони забезпечують синтез білків, необхідних для ранніх стадій онтогенезу. У певний момент материнські мРНК починають знищуватися. Це відбувається як раз тоді, коли зародок починає сам виробляти мРНК, тобто включає свої гени. Цей досить швидкий процес заміни зародком материнських мРНК на свої власні називається maternal- zygotic transition (MZT).
Менш зрозуміле питання про те, що рухає процесом MZT. Передбачається три можливих механізму. 1. У міру зростання числа клітин, з яких складається зародок, починає позначатися нестача тих речовин (що б вони з себе представляли), які не дозволяють генам зародка включитися. Ранні стадії ембріогенезу тварин не випадково називають "дробленням": зигота саме дробиться, клітини ембріона після кожного ділення стають все дрібніше, оскільки між клітинними розподілами відсутня стадія росту клітин. Загальна кількість цитоплазми не росте, тоді як кількість клітинних ядер, а отже і ДНК, збільшується в геометричній прогресії. Якщо припустити, що яйцеклітина заздалегідь запаслася якимись інгібіторами транскрипції, то кількість цих гіпотетичних інгібіторів, що припадають на кожну клітину, має швидко спадати, і в кінці кінців їх залишається так мало, що вони вже не можуть стримувати транскрипцію.
2. Не виключено, що в зиготі спочатку має місце цілеспрямоване блокування деяких ключових генів, робота яких ініціює транскрипцію. Так, показано, що штучне введення в ембріон потужних активаторів транскрипції (транскрипційних факторів "широкого спектра дії") може викликати передчасне часткове включення ембріонального генома.
3. Нарешті, сама по собі швидка низка клітинних поділів може заважати транскрипції. Адже кожному поділу має передувати подвоєння ДНК (реплікація). В ході дроблення реплікація повинна відбуватися по суті справи безперервно. Тим часом відомо, що реплікація може заважати транскрипції, а під час клітинного поділу (мітозу) можуть відбуватися обрив і знищення тих мРНК, синтез яких ще не закінчився. Може бути, клітини ембріона просто фізично не встигають транскрибувати свої гени? Штучне уповільнення процесу дроблення дійсно може викликати передчасне включення ембріонального генома. До речі, у ссавців дроблення протікає порівняно повільно, не цим пояснюється раннє включення генів зародка?
Втім, жодна з цих теорій не пояснює всієї сукупності наявних фактів. Наприклад, вони не можуть пояснити, чому ембріональні гени включаються не всі відразу, а поступово, в строго визначеному порядку.
Другим суттєвим аспектом MZT є знищення материнських мРНК. Тут, як з'ясувалося, все передбачено заздалегідь: материнські мРНК позначені особливою послідовністю нуклеотидів, розташованої на нетрансльовані (тобто не кодує білок) "хвостику" цих молекул. Серед перших генів, які ембріон включає в процесі MZT, знаходяться гени особливих білків і маленьких РНК, які розпізнають цю послідовність, прикріплюються до неї і тим самим ініціюють знищення материнських мРНК.
До повного розуміння всіх цих процесів науці ще дуже далеко, але справа рухається. Коли основні механізми генної регуляції в ході раннього онтогенезу будуть розшифровані, біологи зможуть впритул зайнятися таким принциповим питанням, а саме - навіщо все це треба? Чому тварини не довіряють своєму геному контроль над ранніми стадіями розвитку, а потім в якийсь момент раптом "перемикаються" з материнських мРНК на свої власні?
Між іншим, ця проблема має не тільки теоретичне, а й практичне значення. Труднощі, з якими стикаються роботи з клонування тварин, багато в чому визначаються тим, що ми ще надто мало знаємо про роботу генів в ході раннього розвитку. Клонування тварин здійснюється шляхом пересадки ядра з соматичної (нестатевий) клітини однієї тварини в яйцеклітину іншого. Однак для нормального розвитку необхідно, щоб гени зародка спочатку мовчали, а вони в донорському ядрі цілком активні. Цитоплазма яйцеклітини повинна якимось чином "перепрограмувати" ядро, вимкнути геном, а потім в потрібний момент знову включити його. Поки ми не знаємо, як їй в цьому допомогти, великих успіхів в клонуванні очікувати важко.
Розгаданий механізм регенерації кінцівок. "Генетична програма" індивідуального розвитку дуже тісно пов'язана з іншою "програмою", на основі якої відбувається регенерація - загоєння ран і відрощування втрачених частин тіла. Вивчаючи регенерацію, вчені одночасно проникають в таємниці онтогенезу і навпаки.
Біологи з Іспанії і США недавно провели серію генно-інженерних експериментів, в результаті яких їм вдалося показати, що регенерація кінцівок у хребетних йде під керуванням тих же регуляторних білків, які обіймають керівні посади розвитком кінцівок у ембріона. Білки, про які йде мова, утворюють два сигнально-регуляторних каскаду, які називаються Wnt / beta-catenin (про роль білка Wnt в розвитку хробака Caenorhabditis elegans говорилося вище в сюжеті "Розвиток хробаків починається з хвоста") і BMP (за назвою ключового учасника каскаду - білка BMP, bone morphogenetic protein).
Для першого експерименту вчені сконструювали спеціальний вірус, в геном якого був вбудований ген білка, блокуючого роботу Wnt-каскаду. Введення вірусу аксолотля знизило здатність до регенерації. У аксолотля в нормі відрізані кінцівки відновлюються повністю, однак у заражених штучним вірусом аксолотлів замість лапи виростала лише загострена кукса без пальців.
Цей експеримент показав, що нормальна робота Wnt-каскаду - необхідна умова регенерації, але чи є вона також і достатньою умовою? Щоб перевірити це, вчені поставили експеримент на шпорцевой жабі, у якій на відміну від аксолотля здатність до регенерації є тільки у пуголовків, а з віком ця здатність втрачається. Був сконструйований ще один вірус, що виробляє білок бета-катенин - один з ключових учасників Wnt-каскаду. Введення цього вірусу покращувало здатність шпорцевих жаб до регенерації кінцівок на тих стадіях розвитку, коли ця здатність вже ослаблена. Однак у дорослих жаб, повністю втратили здатність до регенерації, цього не спостерігалося. Отже, для регенерації необхідно щось ще, крім Wnt-каскаду.
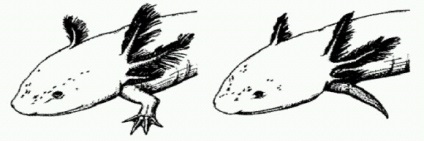
Нормально регеніріровавмая після ампутації кінцівку аксолотля (зліва) і недорозвинена кінцівка у особини, якій був введений Axin1 - інгібітор Wnt-каскаду.
Третім піддослідним об'єктом стала рибка даніо (Danio rerio). У нормі ця рибка здатна заново відрощувати втрачені плавники. Раніше було показано, що різні інгібітори Wnt-каскаду знижують цю здатність (так само як у аксолотля і шпорцевой жаби). Щоб перевірити, чи здатне активування Wnt-каскаду посилити здатність до регенерації у даніо, дослідники використовували рибок, які втратили цю здатність у результаті мутації. Введення таким рибкам бета-катенінового вірусу призвело до часткового "виправлення" даного дефекту. На даніо дослідникам вдалося також показати, що для успішної регенерації крім Wnt-каскаду повинен нормально працювати і сигнально-регуляторний каскад BMP.
Найцікавіше, що обидва каскаду (Wnt і BMP) керують і розвитком кінцівок у ембріонів. На клітинно-тканинному рівні обидва процеси - регенерація і розвиток кінцівки в ембріогенезі - теж дуже подібні. Всі ці дані вказують на те, що відновлення втрачених кінцівок здійснюється на основі тієї ж самої програми розвитку, яка керує формуванням кінцівок у ембріона. І цю програму, мабуть, можна штучно "включити" навіть у тих тварин, які в нормі взагалі не здатні відновлювати втрачені кінцівки. Адже програма ембріонального розвитку є у всіх!
Вченим вдалося підтвердити це припущення в дослідах на курячому ембріоні. Видалення особливого багатошарового епітелію, розташованого на верхівці зачатка крила, призводить до недорозвинення крила. Однак виявилося, що, якщо активувати у курчати ген бета-Катенін, крило після такої ампутації розвивається набагато краще.
Дослідники зробили з усього цього обережний висновок, що сигнально-регуляторні каскади, керуючі розвитком зародка, ймовірно, стали тим "сирим матеріалом", на основі якого у деяких тварин розвинулася здатність до регенерації. Не виключено, що подальше вивчення цих регуляторних систем дозволить в майбутньому "включати" регенерацію у дорослих тварин, повністю позбавлених здатності до відновлення втрачених частин тіла, в тому числі і у людини.