утворення хімічних зв'язків можливо при наявності в атомі неспарених електронів. в багатьох елементах не всі електрони зовнішнього електронного рівня є неспареними.
наприклад, в атомах кисню і сірки по шість електронів на зовнішньому рівні, але з них тільки два неспарених:
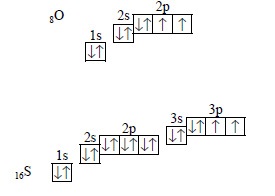
проте, в атомі сірки на зовнішньому електронному рівні є ще порожні 3d-орбіталі, на які можуть переходити електрони з 3s- і 3р-орбіталей, в результаті в атомі сірки стає шість неспарених електронів:
тому максимальна валентність сірки дорівнює шести, тобто збігається з числом електронів на зовнішньому електронному рівні. в атомі кисню на другому рівні немає d-орбіталей, тому немає можливості для розпарювання електронів, і валентність кисню не може бути більше двох, тобто не дорівнює числу електронів на зовнішньому рівні.
Завдання з голови Глава 2. Періодичний закон і періодична система д. І. Менделєєва на основі вчення про будову атома. (Завдання до §1-3) по предмету Хімія з задачника Хімія 11, Рудзитис, Фельдман (11 клас)
Якщо до цього завдання немає рішення - не переживайте. Наші адміністратори намагаються доповнювати сайт рішеннями для тих завдань і вправи, як цього вимагає і які не дані в розв'язнику і збірниках з ГДЗ. Спробуйте зайти пізніше. Ймовірно, ви знайдете те, що шукали :)
Раді вітати учнів всіх навчальних закладів різного віку на нашому сайті! Тут ви знайдете решебники і рішення задач безкоштовно, без реєстрації.
davay5.com