Делокалізація молекулярних орбіталей в металах
Яким чином електрони можуть рухатися крізь шматок металу? У чому різниця між металом і діелектриком? Що таке напівпровідники? Чому метали нагріваються під час руху електронів? Що таке надпровідність?
Щоб відповісти на перші три питання, треба розширити обговорення делокалізованних молекулярних орбіталей, виявлених нами в молекулах ароматичних сполук, таких як бензол і нафталін (див. Розділ 18), на МО макроскопічних шматків металу та інших матеріалів. Для відповіді на два останніх питання знадобиться перейти від обговорення впливу теплових коливань атомів, складових шматок металу, до обговорення руху електронів в металі.
У розділі 10 при обговоренні молекули водню ми дізналися, що дві атомні орбіталі водню об'єднуються і утворюють дві молекулярні орбіталі - зв'язує і розпушують. У разі бензолу ми побачили, що шість атомних pz -орбіталей - по одній від кожного атома вуглецю - утворюють три зв'язують і три розпушують МО. У нафталіну десять атомних pz -орбіталей об'єднуються і утворюють десять МО - п'ять зв'язують і п'ять розпушуючих. У кожному разі ці МО охоплюють всю молекулу. У розділі 11, присвяченій Періодичної таблиці елементів, ми говорили, що натрій (Na) є металом, оскільки має один електрон (3s) понад замкнутої неонової конфігурації оболонки. Na легко віддає цей електрон для освіти солей, таких як кухонна сіль NaCl. У воді NaCl розчиняється і перетворюється в іони Na + і Cl -. Як вже говорилося, в твердому стані Na є металом і проводить електрику, і тепер ми готові пояснити чому.
Розглянемо для початку 3s орбіталі двох атомів натрію, які знаходяться поруч один з одним і взаємодіють. У натрію 3s-електрон є валентним, тобто бере участь в утворенні зв'язків. У верхній частині рис. 19.2 показані енергетичні рівні двох атомних 3s -орбіталей, які об'єднуються в молекулярні орбіталі. Енергетичний рівень однієї з цих МО нижче, ніж у атомних орбіталей. Це зв'язує МО. Інша МО має більш високий рівень енергії - це розпушуються орбіталь. У середній частині малюнка видно, що три атомні орбіталі утворюють три МО. Внизу представлена ситуація з шістьма взаємодіючими атомами натрію. Шість атомних 3s -орбіталей об'єднуються в шість МО - три зв'язують і три розпушують.
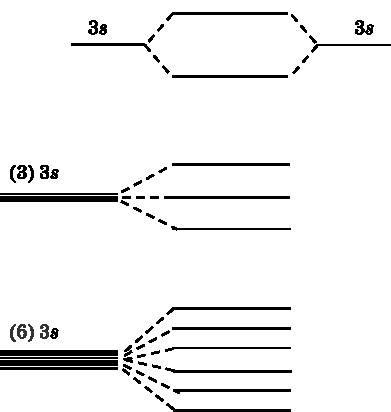
Мал. 19.2.Вверху: дві атомні 3s-орбіталі натрію взаємодіють і породжують дві молекулярні орбіталі - одну з більш низькою енергією (зв'язує) і одну з більш високою (розпушує). В середині: три атомні 3s-орбіталі взаємодіють і утворюють три МО. Внизу: шість атомних 3s-орбіталей об'єднуються в шість МО
Кожен атом Na володіє одним 3s -Електронна, який піде на заповнення МО. В системі з шістьма атомами натрію для заповнення МО буде шість електронів. Кожна МО може прийняти два електрони з протилежними спинами (один спрямований вгору, інший - вниз). Тому електронами будуть заповнені три МО з найменшими енергіями, тобто зв'язують МО. Три МО з більш високими енергіями залишаться порожніми.
Тепер нам треба розглянути, що відбудеться в разі дуже великого числа взаємодіючих атомів натрію. Візьмемо стрижень довжиною 10 см і діаметром 1 мм. що складається з натрію (див. рис. 19.1). При таких розмірах число атомів Na, які буде містити стрижень, складе N = 2 • 10 21 (два мільярди трильйонів) атомів Na. Два мільярди трильйонів атомних 3s -орбіталей об'єднуються в два мільярди трильйонів молекулярних орбіталей. Як і в разі МО бензолу і нафталіну, МО натрієвого стрижня слід вважати поширюються на всю систему, тобто на весь шматок металу.