Таблиця 1. Класифікація детергентів.
Детергенти являють собою органічні сполуки які з гідрофобного вуглеводневої фрагмента і гидрофильной зарядженої головної групи (рис. 1А). При розчиненні в воді при певній концентрації і температурі молекули детергенту утворюють міцели, з гідрофобною частиною всередині міцели і головний групою на зовнішньої (рис. 1В). Таким чином, гідрофобна ядро міцели зв'язується з гідрофобними ділянками білків. Кількість молекул детергенту в міцелі називається числом агрегації, яке є важливим параметром, використовуваним для оцінки розчинності мембранних білків [2]. Довжина гидрофобного ділянки прямо пропорційна ступеню гідрофобності і цілком постійна для різних детергентів, в той час як заряджена головний група є змінною і, виходячи з її характеристик, детергенти поділяються на три типи: іонні (аніонні або катіонні), цвіттеріонов і неіонні. Мінімальна концентрація детергентів, при якій міцели виявляються при даній температурі, називається критичної міцелярної концентрацією (КМК). При концентрації нижче КМК, спостерігаються тільки мономери; при концентраціях вище КМК, міцели і мономери співіснують з іншими неміцеллярной фазами, які не розчиняються у воді. Крім того, низька температура, при якій формуються міцели, називається критичної міцелярної температурою (КМТ). Таким чином, температура і концентрація є важливими параметрами поділу фаз і розчинності миючого засобу. КМК також залежить від ступеня ліпофільності головної групи. Як правило, низька липофильность або ліпофобних призводить до високої КМК.
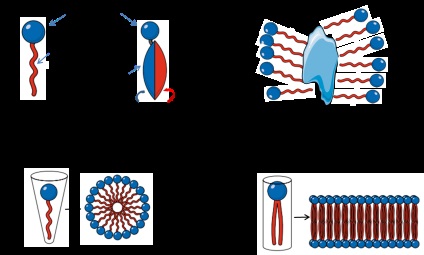
Figure 1. Загальна структура мономерів детергента. Адаптовано з Anatrace.
Іонні детергенти складаються з гідрофобної ланцюга і зарядженої головної групи, яка може бути або аніоном або катіоном. Як правило, вони мають більш високу КМК, ніж неіонні детергенти. Ці детергенти сильніші.
Додецилсульфат натрію (SDS) - аніонний SDS є дуже ефективним поверхнево-активною речовиною для колоїдного розчинення майже будь-якого білка. Він руйнує Нековалентні зв'язку білків, таким чином викликаючи їх денатурацію, що призводить до втрати їх нативної конформації і функції. SDS зв'язується з білком у ваговому співвідношенні 1,4: 1 (або один SDS-аніон на дві амінокислоти) і, отже, маскує заряд білка, що додає негативний заряд для всіх білків в зразку, незважаючи на їх ізоелектричної показник (PI). Це є основною причиною його широкого використання в денатурує SDS електрофорезі в поліакриламідному гелі (SDS-PAGE). Як правило, для повного лізису клітин в присутності SDS, зразок повинен бути гомогенізовані ультразвуком (підданий ультрасонікаціі) і пропущений кілька разів через голку (19G), щоб забезпечити деградацію ДНК. Так як SDS викликає денатурацію білків і руйнує їх 3-мірну структуру, його не слід використовувати у випадках, коли потрібні активні білки або при вивченні міжбілкового взаємодій. Додаткові заходи безпеки повинні бути прийняті при використанні іонних детергентів, тому що деякі їх властивості можуть змінюватися в буферних розчинах зі змінною іонною силою (наприклад, КМК падає до 0,5 від 8 ммоль при збільшенні концентрації NaCl від 0 до 500 ммоль). Крім того, SDS випадає в осад при низькій температурі, внаслідок одного з найвищих КМТ серед детергентів, і цей ефект посилюється в присутності солей калію. Це явище може бути використано для очищення білкового зразка від SDS [3].
Через їх заряджених полярних головних груп іонні детергенти не можуть бути вилучені шляхом іонообмінної хроматографії.
Неіонні детергенти відрізняються від іонних тим, що їх головний група не заряджена і гідрофільна. Вони вважаються м'якими поверхнево-активними речовинами, так як вони руйнують білково-ліпідні і межліпідние, але не міжбілкового взаємодії і більшість з них не викликає денатурації білків. Таким чином, білки можуть бути розчинені і ізольовані в своїй природній і активній формі зі збереженням білкових взаємодій. Це їх основна перевага і їм віддається перевага при ізоляції мембранних білків.
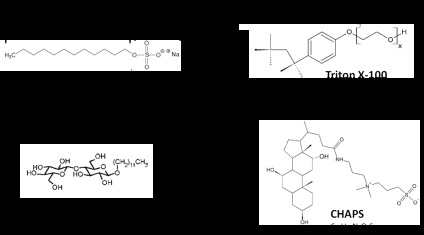
Figure 2. Структура і формули найбільш використовуваних детергентовю Адаптовані з G- Biosciences.
Тритон Х-100 є найбільш характерним прикладом неионного поверхнево-активної речовини, пріоритетним для більшості експериментів з використанням иммунопреципитации. Всі члени цієї групи (Triton X100, Triton X114, Nonidet P40, Igepal ® CA-630) дуже схожі і відрізняються лише середнім числом (N) мономерів в міцелі (9,6, 8,0, 9,0 і 9,5, відповідно) і за розміром PEG головної групи [4] .Triton X100 є похідним поліоксиетилену і містить алкілфенільную гидрофобную групу. КМК має низьке значення і, отже, Тритон Х-100 нелегко видалити за допомогою діалізу. Температура формування осаду - 64 o C і при цій температурі спостерігається поділ фаз.
Н-додецил-β-D-мальтозід (DDM) являє собою поверхнево-активний гликозидной отримав широке застосування для екстракції гідрофобних і мембранних білків, у випадках вимагають збереження активності. Він є більш ефективним, ніж інші поверхнево-активні речовини, наприклад, CHAPS або NP-40 [5]. Глікозидна ланцюжок в його ліпофільних ділянках, висока КМК (0,17 ммоль) і внутрішня поверхня міцел створює водоподобное микроокружение, яке ідеально підходить для колоїдного розчинення і збереження стабільності мембран і гідрофобних білків.
Дигітоніну отримують з фіолетовою наперстянки (Digitalis purpurea), він використовується для еукаріотичних плазматичних мембран. Саркозі і Triton X-100 можуть солюбілізувати внутрішню, але не зовнішню бактеріальну мембрану.
Tween-20 і Tween-80 відносяться до полісорбатним поверхнево-активних речовин складається з ефіру жирної кислоти і довгою поліоксіетіленовой ланцюга. Вони мають дуже низьку КМК і, як правило, є м'якими поверхнево-активними речовинами, вони не впливають на активність білка і ефективні для солюбілізації. Вони не часто є інгредієнтами буферних розчинів для лізису клітин, і їх звичайними додатками, як детергентів, є імуноблотинг і ELISA, оскільки вони допомагають мінімізації неспецифічного зв'язування антитіл і в видаленні незв'язаних фрагментів.
Більшість неіонних детергентів можуть перешкоджати ультрафіолетової (УФ) спектрофотометрії, особливо Triton X100, так як вони містять фенільне кільце і поглинають УФ світло. Таким чином, ідентифікація білка при 280 нм буде неточною.
Головні групи цвіттеріонов або амфотерних детергентів є гідрофільними і містять позитивний і негативний заряди в рівних кількостях, результатом чого є нейтральний сумарний заряд. Вони, як правило, більш жорсткі, ніж неіонні поверхнево-активні речовини. Найбільш характерним прикладом цвіттеріонов або амфотерних детергентів є 3 - [(3-холамідопропіл) діметіламмоніо] -1-пропансульфонат, більш відомий як CHAPS. Його висока КМК (6 ммоль при кімнатній температурі) дозволяє ефективно видаляти за допомогою діалізу. Це часто застосовується в підготовці проб при концентрації 2-4% для ізоелектричної фокусування і 2D-електрофорезу. CHAPSO відрізняється від CHAPS, що він містить більше полярну головну групу що робить його більш розчинним. Таким чином, він в основному використовується для колоїдного розчинення інтегральних мембранних білків.
Хаотропние агенти подібні поверхнево-активних речовин тим, що вони порушують Нековалентні взаємодії (водневі зв'язки, диполь-дипольні взаємодії, гідрофобні взаємодії), сприяючи денатурації білка, яка в даному випадку, як правило, оборотна. Сечовина окремо або в комбінації з тіомочевиною або іншими детергентами, є найбільш широко використовуваним хаотропом з використанням в 2D-гелевом електрофорезі і ферментативном розщепленні білків в розчині для протеомних поточних процесів. При використанні сечовини, слідують дотримуватися особливої обережності, щоб не нагрівати зразки вище 37 o C так як це призводить до карбамілірованію білків [6].
Детергенти для виділення мембранних білків
Виділення мембранних білків представляє певний інтерес, але при цьому має певні труднощі в порівнянні з виділенням цитозольних і нуклеоплазматіческіх білків. Основними причинами є труднощі їх солюбілізації у водних розчинах, складна структура ліпідного шару, їх гідрофільні і гідрофобні домени і низький рівень їх експресії. Для розчинення мембранних білків повинні бути обрані детергенти з високою КМК. Також важливий і обсяг буферного розчину, оскільки, щоб розчинити всі мембранні білки в зразку, необхідна достатня кількість детергента. Згідно Linke [2]. необхідна принаймні одна міцела на один мембранний білок, щоб в достатній мірі імітувати липидную мембранну середу (рис. 1С-D). В принципі, шляхом зміни температури і концентрації солі в буферному розчині, ефективне розчинення мембранних білків може бути досягнуто скориставшись поділом фаз. В цьому випадку мембранні білки, оточені мицеллами, осідають з детергентом, а розчинні білки залишаються в надосадової рідини. Температура, при якій детергент розділяється на дві фази, називається точкою помутніння. На додаток до температурі, точка помутніння залежить від добавок в буферний розчин, таких як гліцерин або солі (наприклад, Тритон X114 має точку помутніння 23 o C але в присутності 20% гліцерину, точка помутніння знижується до 4 o C). Це дуже важливо, коли стабільність білка піддається впливу високих температур.
Хороший детергент повинен лизировать клітини, солюбілізувати білки і бути придатним для наступних методів. Вибір розчинної білка в нативної або денатурированной формі, є другим питанням, яке має бути дана відповідь. Не існує ідеального детергента, придатного для всіх додатків, і навіть в одному і тому ж те ж додатку результат буде варіювати в залежності від даного білка (табл. 2). Таким чином, методом проб і помилок є тут найкращою стратегією і різні детергенти повинні бути протестовані. Крім того, кращою практикою, що дозволяє уникнути гідролізу і окислення, є приготування свіжого робочого розчину детергенту.