Хімія екстремальних станів
На відміну від каталітичної хімії, особливістю якої є хімічна активізація молекул реагенту, тобто розслаблення вихідних хімічних зв'язків при взаємодії з їх каталізатором, хімія екстремальних станів характеризується енергетичної активацією реагенту, тобто подачею енергії ззовні для повного розриву вихідних зв'язків.
У плазмохимических процесах швидкість перерозподілу хімічних зв'язків між реагують молекулами досягає оптимуму, заданого природою: тривалість елементарних актів хімічних перетворень наближається в ньому до 10 -13 сек при майже повній відсутності оборотності реакції. Тому плазмохімічні процеси виключно високопродуктивні.
Створюється плазмохімічноїтехнологія виробництва дрібнодисперсних порошків - основної сировини для порошкової металургії.
Плазмохимія дозволяє отримати такі матеріали, які до сих пір взагалі не були відомі людині, наприклад, металлобетонная, де в якості сполучного використовуються сталь, чавун, алюміній. Плазмова технологія дозволяє шляхом оплавлення частинок гірської породи створити міцне зчеплення цієї породи з металом, завдяки чому отримується металлобетонная міцніше звичайного на стиск в 10 і на розтягнення в 100 разів.
У Росії розроблені плазмохімічні процеси перетворення вугілля в рідке паливо, що усувають застосування високих тисків і викиди сірки і золи.
Радіаційна хімія. Початок її було покладено опроміненням поліетилену з метою надання йому великий міцності. Найбільш важливими процесами радіаційно-хімічної технології є полімеризація, вулканізація, виробництво композиційних матеріалів, закріплення лаків і інших криють матеріалів на поверхні дерева і металу, отримання полимербетонов шляхом просочення звичайного бетону тим чи іншим мономером з подальшим опроміненням.
Принципово новою і важливою областю хімії екстремальних станів є високотемпературний синтез (СВС) тугоплавких і керамічних матеріалів. Метод СВС - це результат розвитку теплової теорії процесів горіння і вибуху в твердих тілах. Він заснований на реакції горіння одного металу в іншому або металу в азоті, вуглеці, кремнії. Методом СВС отримані сотні тугоплавких сполук чудової якості.
Нові підходи до синтезу нових неорганічних матеріалів
В останні роки спостерігається інтенсивний розвиток різних галузей науки і техніки, пов'язаних із застосуванням неорганічних матеріалів - це і машинобудування, і космічна і військова промисловість, і атомна галузь. Постановка цих питань змушує шукати нетривіальні способи вирішення, наприклад, вирощувати деякі кристали в космосі або використовувати вибухові технології.
Що ж можуть запропонувати вчені, щоб розширити діапазон застосовуваних методик при створенні (синтезі) нових матеріалів, з огляду на роль хімічних процесів? Здавалося б, із зменшенням температури має зменшаться число активних молекул і, отже, швидкість реакції. Але несподівано виявилося, що можливий синтез матеріалів при низьких температурах рідкого азоту - ми говоримо про кріохімія. В цьому випадку протікання реакцій при низьких температурах пов'язано зі зміною механізму процесу, оскільки утворюються легко розкладаються (термічно нестійкі) молекулярні комплекси, які і беруть участь в даному хімічному процесі. Крім того, зниження температури по-різному впливає на механізм супутніх один одному взаємодій, що дозволяє реалізувати високо селективний хімічний процес (побічні хімічні процеси при низьких температурах придушуються).
Ідея кріохіміческой технології твердофазних матеріалів, що зародилася понад тридцять років тому в Московському державному університеті і вперше реалізована академіком Ю.Д. Третьяковим, дозволяє отримувати на основі кріопорошков високоякісну кераміку.
Інший приклад нового напряму в синтезі матеріалів лежить далеко від низьких температур - в області високих температур, при яких здійснюються реакції горіння одного металу в іншому або металу в азоті, вуглеці, кремнії. Це так званий високотемпературний синтез (СВС) тугоплавких матеріалів, відкритий в 1967 році академіком Мержанова А.Г.
В суміші порошків в одному місці здійснюється локальний розігрів ( «підпал») і починається реакція синтезу. Виділилася в результаті екзотеpміческой реакції тепло нагріває сусідні (більш холодні) шари речовини, в яких порушується реакція і виникає самоподдерживающийся процес. У такому процесі хімічна реакція, що супроводжується яскравим світінням, протікає у вузькій зоні, яка самовільно поширюється по матеріалу. Такий процес є різновидом горіння і розглядається на основі теорії горіння.
Не зупиняючись детально, перерахуємо ще ряд нових, цікавих і перспективних наукових напрямків, які використовують різні нетрадиційні підходи до синтезу матеріалів:
· Механохімія - вивчає перетворення речовини при механічних впливах (тертя, ультразвукове опромінення, вибух). МЕХАНОХІМІЧНО реакції пов'язані з переходом речовини в метастабильное хімічно активний стан, а також інтенсифікацією масопереносу в результаті поглинання механічної енергії.
· Плазмохимія - вивчає хімічні процеси в низькотемпературній плазмі. Основна особливість таких процесів пов'язана з утворенням великої кількості різноманітних реакційноздатних часток (збуджених молекул, електронів, атомів, атомарних і молекулярних іонів, вільних радикалів, причому виникнення деяких з таких частинок можливо тільки в плазмі), які обумовлюють нові типи хімічних реакцій.
· Лазерна хімія - вивчає хімічні процеси, стимульовані лазерним випромінюванням. Наприклад, селективність процесів пов'язана з високоюмонохроматичністю лазерного випромінювання, що дозволяє порушувати молекули тільки одного виду; велика інтенсивність лазерного випромінювання дає можливість отримувати порушені реакційні частинки в високих концентраціях.
· Радіаційна хімія - вивчає вплив іонізуючого випромінювання здійснюватиме на хімічні процеси.
В даний час активно розвиваються нові технології виробництва матеріалів: найбільш модним, цікавим і можливо, перспективним є підхід, який базується на створенні наноматеріалів різноманітних типів. До наноматеріалів відносяться матеріали, розмір яких становить 10-100 нм (1 нм = 10 -9 м), тобто це порошки дуже «тонкого помелу». В цьому випадку потрібно враховувати, що фактично не залишається «внутрішніх» атомів, які знаходяться в об'ємі частинки - велика частина атомів знаходиться на поверхні частинки. Виявилося, що такі матеріали мають властивості, недосяжними для звичайних об'єктів: наприклад, міцність нанокерамікі зростає в десятки разів у порівнянні з міцністю кераміки, отриманої за стандартною технологією.
Говорячи тільки про нові твердотільних матеріалах, можна дивуватися, наскільки широкий їх спектр - це матеріали з надвисокими температурами плавлення для реакторів атомних станцій; нові оптоволоконні скла для кабелю, по якому йде передача величезних обсягів інформації через Інтернет; «Розумні» матеріали з пам'яттю форми або скла з регульованим «пропусканням світла»; біоматеріали для кісткових протезів, що не відриваються людським організмом; матеріали для молекулярних комп'ютерів і т.п. З нових перспективних функціональних матеріалів зупинимося трохи докладніше на двох цікавих класах - надпровідниках і твердих електролітах.
Зі шкільного курсу відомо, що метали краще за інших матеріалів проводять електричний струм, причому електроопір металів зменшується при зниженні температури. (Чому?) У 1911 року, коли надпровідність була відкрита знаменитим голландським фізиком Х. Камерлінг-Оннес виявив, що при температурі 4.2 До електричний опір твердої ртуті стає рівним нулю. Незабаром було показано, що і в ряді інших металах при дуже низьких температурах (5-10 К), тобто близько температури абсолютного нуля, опір зникає, стає практично рівним нулю і з'являється надпровідність. За своєю природою надпровідність - це квантовий ефект: електрони в надпровідниках поводяться як сукупність так званих «куперовских пар», і рухаються через кристалічну решітку металу, не помічаючи «самих атомів».

Тверді електроліти, або суперіонного провідники
Зі шкільного курсу фізики відомо, що існують електричні провідники 1-го і 2-го роду: в провідниках 1-го роду ток переноситься електронами, а в провідниках 2-го роду - іонами. При цьому прикладами провідників 2-го роду зазвичай служать розчини електролітів, оскільки в твердих тілах великим іонів важко рухатися в кристалічній решітці. Тому більшість батарей використовують різного роду рідкі електроліти. Однак виявилося, що є сполуки, структура яких влаштована таким чином, що в ній існує вільний простір, по якому можуть рухатися досить легко іони невеликого розміру (Li +. Na +. Ag +). При цьому виявляється, що іонна провідність таких матеріалів можна порівняти з іонною провідністю рідких електролітів, через що ці сполуки отримали назву твердих електролітів (або суперіонних провідників, що підкреслює високі значення іонної провідності). В даний відома велика кількість твердих електролітів, в яких провідність забезпечується найрізноманітнішими катіонами - срібла, міді, літію, а також аніонами - кисню, фтору.
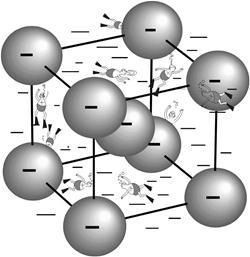
Схематичний вид структури іонного провідника AgI (кулі - аніони йоду, плавці - катіони срібла).
Не слід вважати, що суперіонного фази - якась екзотика: виявилося, що до складу мантії Землі входять NaMgF3 і MgSiO3. які проявляють твердоелектролітіческіе властивості при високих температурах. Навіть добре відома вода підносить сюрпризи: недавно було розраховано екзотичне стан води: ні лід, ні газ, ні рідина, а - суперіонік.
Матеріали, що володіють суперіонної провідність, знаходять застосування в різного виду акумуляторах і батареях, паливних елементах і газових сенсорах.
Як зазначалося на самому початку цієї глави, сьогодні хімія переходить на новий етап - етап еволюційного розвитку. Це означає, що вчені думають про те, чи можна вирішити проблему самовільного (без участі людини) синтезу нових хімічних сполук. Академік А.Е.Арбузов писав: «Чим же хімія майбутнього повинна відрізнятися від хімії сьогодення? Наслідування живій природі є хімія майбутнього! І в той день, коли в лабораторії буде синтезований перший фермент, тобто биокатализатор, ми можемо сказати, що наука отримала в свої руки ключ, який вона так довго і наполегливо шукає, - це ключ до хімії живої природи ». На цьому шляху необхідно можливе вирішення кількох завдань в області каталітичної хімії:
· Розвиток досліджень в області металлокомплексного каталізу з орієнтацією на відповідні об'єкти живої природи;
· Моделювання біокаталізаторів на основі ферментів з високою активністю і селективністю;
· Створення іммобілізованих систем (стабілізація виділених з живого організму ферментів на твердій поверхні) для їх використання в якості гетерогенних каталізаторів;
· Застосування принципів биокатализа в хімії та хімічній технології.
Наприклад, за принципом ферментів будуть створені каталізатори, набагато ефективніше наявних, або побудовані перетворювачі (з більшим ККД) сонячного світла в хімічну та електричну енергію, як це роблять живі організми.
5. Нерівноважні процеси в хімії. Самоорганізація в хімічних системах.
До недавнього часу про еволюційної хімії нічого не було відомо. На відміну від біологів, хіміків не цікавив питання про «походження видів» речовини, тому що отримання будь-якого нового хімічної сполуки завжди було справою рук і розуму людини: нова молекула конструировалась їм за законами структурної хімії з атомів і атомних груп, як будівля з цегли. Живі організми з блоків зібрати не можна.
Виникнення еволюційної хімії пов'язане з необхідністю зрозуміти, як з неорганічної матерії виникає органічна, а разом з нею і життя. Еволюційна хімія - наука про самоорганізацію і саморозвиток хімічних систем. Вона вивчає процеси мимовільного синтезу нових хімічних сполук, що є більш складними і високоорганізованим в порівнянні з вихідними речовинами.
Головним предметом вивчення в еволюційної хімії є еволюція хімічних сполук (хемогенез), яка забезпечила перехід до біогенезу. Біогенез - утворення органічних сполук живими організмами. Розуміння механізму хемогенеза важливо для прояснення проблеми походження життя на Землі і процесів самоорганізації матеріальних систем.
Існує два різних підходи до проблеми самоорганізації передбіологічних систем -субстратний і функціональний.