Електрична провідність (L) - це здатність речовини проводити електричний струм під дією зовнішнього електричного поля. За фізичним змістом ця величина обернено опору (R):
де # 961; - питомий опір, Ом / м; S - поперечний переріз провідника, м 2; l - довжина провідника, м.
Розрізняють питому і молярну електричні провідності розчинів електролітів.
Питома електрична провідність (# 954;) - електрична провідність об'єму розчину, укладеного між двома паралельними електродами площею 1 м 2. розташованими на відстані 1 м один від одного. Питома електрична провідність є величиною, зворотної питомому опору.
Одиницею вимірювання питомої електричної провідності: Ом -1 м -1 = См / м (См - сименс).
В електрохімії часто користуються традиційним визначенням питомої електричної провідності: це електрична провідність стовпчика речовини довжиною 1 см і з перетином 1 см 2. при цьому розмірність Ом -1 см -1 = См / см.
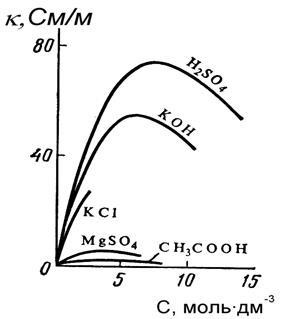
Питома електрична провідність електролітів визначається кількістю і зарядом іонів, що переносять електрику, а також швидкістю їх руху в електричному полі. Графік залежності # 954; від концентрації розчину для сильних електролітів є кривою з чітко вираженим максимумом, а для слабких - цей максимум в значній мірі розмитий і практично не проявляється (рис. 5.1). В області малих концентрацій розчинів сильних і слабких електролітів зростання електричної провідності обумовлений збільшенням кількості іонів - переносників електрики.
При збільшенні концентрації зростає щільність розчину, що знижує швидкість руху іонів, при цьому у слабких електролітів помітно знижується ступінь дисоціації; тому # 954; для помірно слабких електролітів починає зменшуватися в області значно більше розведених розчинів і зростання електропровідності практично не спостерігається, а максимум на кривій виходить дуже пологим.
Підвищення температури на 1 К збільшує питому електропровідність на 2-2,5% для сильних електролітів за рахунок зниження в'язкості розчину і ущільнення гідратованих іонів, а для розчинів слабких електролітів - за рахунок збільшення ступеня дисоціації в разі ендотермічної реакції розчинення електроліту.
На величину питомої електричної провідності, крім перерахованих факторів, впливає валентність (заряд) іона: чим більше заряд іона, тим більша кількість електрики він переносить.
Молярна електрична провідність (# 955;) - електрична провідність об'єму розчину електроліту, що містить 1 моль-еквівалент розчиненої речовини, що знаходиться між двома паралельними електродами, розташованими на відстані 1 м один від одного. Одиницею вимірювання молярної електричної провідності є: Див # 8729; м 2 / моль.
Питома і молярна електричні провідності пов'язані між собою співвідношенням:
де С - молярна концентрація розчиненої речовини, моль / л; # 955; - молярна електрична провідність, См # 8729; м 2 / моль; # 954; - питома електрична провідність, См / м.
залежність # 955; від швидкості руху для одно-одновалентних іонів виражається рівнянням:
де u + і u- - абсолютні швидкості руху позитивних і негативних іонів відповідно, # 945; - ступінь дисоціації електроліту, F - постійна Фарадея.
Для сильних електролітів можна прийняти a = 1, тому
Твори і називаються подвижностями іонів:
Для гранично розбавлених розчинів (С → 0, # 945; → 1) справедливо рівність:
де і - рухливості іонів при граничному (нескінченному) розведенні, є специфічними величинами для іонів; - електрична провідність гіпотетичного нескінченно розведеного розчину, що характеризується повною дисоціацією електроліту і відсутністю сил електростатичного взаємодії між іонами.
Рівняння (5.25) справедливо як для сильних, так і для слабких електролітів і називається законом незалежного руху іонів Кольрауша (законом адитивності електричної провідності). Відповідно до закону Кольрауша, молярна електрична провідність при граничному розведенні дорівнює сумі подвижностей іонів при граничному розведенні.
Чисельні значення подвижностей іонів і в даний час оцінені практично для всіх іонів і наводяться в довідниках. Наприклад, користуючись довідковими даними, молярну електричну провідність гранично розведеного розчину оцтової кислоти можна визначити:
Порівняння чисельних значень для різних іонів показує, що аномально високими величинами електричних провідностей у водному розчині мають іони гідроксонію і гідроксилу. Це пояснюється естафетному механізмом переміщення зазначених іонів в розчині. Тому розчини кислот і лугів в порівнянні з розчинами солей при однакових концентраціях мають більшу електричну провідність.
У розведених розчинах слабких електролітів електричне взаємодія між іонами мало, тому:
З виразу (5.26) випливає, що ступінь дисоціації розчину слабкого електроліту при зміні концентрації можна визначити, використовуючи експериментальні дані значень молярної електричної провідності його розбавлених розчинів. Так як для електроліту постійна, то зміна електричної провідності розведеного розчину слабкого електроліту при зміні його концентрації визначається тільки залежністю a від концентрації розчину.
У розчинах сильних електролітів зміна молярної електричної провідності з концентрацією обумовлено впливом електростатичного взаємодії іонів на швидкість їх руху.
Графік залежності молярної електричної провідності від концентрації розчину для слабких електролітів виражається більш крутим зменшенням при збільшенні концентрації, ніж крива цієї ж залежності для сильних електролітів (рис.5.2).
Рис.5.2. Залежність молярної електричної провідності розчинів слабких (1) і сильних (2) електролітів від їх концентрації.
Залежність молярної провідності розчину від концентрації сильних електролітів вивчалася багатьма дослідниками. Найбільш відомо емпіричне рівняння Кольрауша для розбавлених розчинів, зване законом квадратного кореня:. (5.27) де h - емпіричний коефіцієнт. Ця залежність підтверджена численними експериментами і теоретично обгрунтована в теорії Дебая - Хюккеля - Онзагера.
За цією теорією зменшення молярної електричної провідності розбавлених розчинів сильних електролітів при збільшенні концентрації електроліту пояснюється зменшенням швидкості руху іонів за рахунок електростатичного взаємодії іонів, оточених їх іонними атмосферами, при русі таких іонів в електричному полі.
Кондуктометрія - метод дослідження, заснований на вимірюванні електричної провідності розчинів електролітів. Цей метод досить простий, точний, дозволяє вирішити ряд важливих науково-дослідних і виробничих завдань. Вимірюючи електричну провідність розчинів, визначають основність органічних кислот, розчинність і твір розчинності малорозчинних сполук, константу і ступінь дисоціації слабких електролітів, ступінь мінералізації ґрунтів, вод і грунтів. Широко використовується Кондуктометричне титрування різних (особливо митних) розчинів.
Експериментальне визначення електричної провідності розчину електроліту засноване на вимірі опору розчину при проходженні електричного струму методом компенсації. Для цього використовується мостова схема (рис.5.3):
Рис.5.3. Схема установки для вимірювання електричного опору розчину: АВ - реохорд з фіксованими значеннями опорів в різних положеннях ковзаючого контакту С; Rм - магазин опорів; Rx - посудину з досліджуваним розчином, опір якого слід визначити; Г - нуль-інструмент (гальванометр або осцилограф); - генератор струму високої частоти.
Переміщаючи контакт З по реохорд АВ, домагаються відсутності струму або його мінімуму в ланцюзі CD. При цьому справедливо співвідношення:. звідси:
Змінний струм високої частоти (в схемі вимірювання) використовується для того, щоб уникнути наслідків електролізу на електродах в посудині з досліджуваним розчином і для зменшення ємнісного опору.
Приклад 5.3. Дві нікелеві пластини, площею по 4 см 2 кожна, розташовані паралельно один одному на відстані 11 см. Простір між ними заповнений розчином 0,34 М NiSO4. Молярна електрична провідність цього розчину дорівнює 98,7 Див · см 2 / моль. Яке змінну напругу має бути докладено до пластин, щоб сила струму дорівнювала 0,07 А?
1. Для розрахунку опору розчину розрахуємо питому електричну провідність з значень молярної електричної провідності:
2. Розрахуємо опір розчину:
3. Розрахуємо по закону Ома напруга, прикладена до електродів:
Приклад 5.4. Питома електрична провідність 0,05 М розчину роданида амонію дорівнює 0,572 · 10 -2 См / см. Розрахуйте ступінь дисоціації солі.
1. Розраховуємо молярну електричну провідність за рівнянням (5.21):
2. За довідником знаходимо значення подвижностей іонів і розраховуємо за рівнянням (5.25):
3. Ступінь дисоціації роданида амонію розраховуємо за рівнянням (5.26):
Приклад 5.5. Молярна електрична провідність 0,02 М розчину оцтової кислоти дорівнює 12,77 Див · см 2 / моль. Обчисліть константу дисоціації і рН цього розчину.
1. Згідно з довідковими даними при 25 ° С гранична молярна електрична провідність оцтової кислоти складе:
2. Розрахуємо ступінь дисоціації оцтової кислоти за рівнянням (5.26):
3. Розрахуємо константу дисоціації оцтової кислоти за рівнянням (5.2):
4. Так як оцтова кислота є слабким електролітом, то концентрація іонів водню, отриманих в результаті електролітичноїдисоціації кислоти, буде дорівнює:
5. Розрахуємо рН розчину оцтової кислоти:
Електроліз - процес, в якому хімічні реакції йдуть під дією електричного струму від зовнішнього джерела, при цьому електрична енергія перетворюється в хімічну. Шляхом електролізу можна здійснювати реакції, мимовільне протікання яких неможливо.
Електроліз проводять в електролізерах (електрохімічних комірках), що складаються з двох електродів, занурених у розчин електроліту.
Негативно заряджений електрод, на якому відбувається процес відновлення (приєднання електронів), називається катодом:
Позитивно заряджений електрод, на якому відбувається процес окислення (віддача електронів), називається анодом:
В результаті електролізу на електродах відбувається виділення речовини з розчину електроліту і зміна його складу біля поверхні електродів. Хімічні перетворення при електролізі залежать від природи електроліту і розчинника, матеріалу електрода і присутності інших речовин в розчині.