Чи замислювалися Ви коли-небудь, які сили утримують молекулу речовини від розпаду на атоми? Сьогодні відомо, що ці сили називають хімічними, і вони мають електромагнітну природу. У загальних рисах хімічний зв'язок можна пояснити як результат колективізації зовнішніх - валентних електронів з'єднуються атомів. При певних відстанях між ядрами колективізованих, наприклад, електрони в молекулі водню. проходячи між ядрами, зменшують відштовхування останніх. На великих відстанях колективізація не виникає.
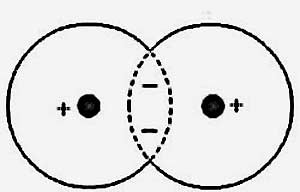
Розглянемо найпростішу молекулу водню Н2. Електрони в молекулі водню поводяться так, як якщо б кожен електрон проводив частину часу біля одного ядра, а частина біля іншого. Саме тому виникають при цьому сили називаються часто обмінними. Тобто, електрони в молекулі водню стали належати вже двом ядрам одночасно. При цьому, індивідуальність атомів водню розчинилася при їх злитті в нову систему - в молекулу водню, в якій тепер знаходиться два протони і два електрони.
У кухонної солі. наприклад, загальними є 8 валентних електронів. Один з них взято у натрію, і 7 - у хлору. Так як залишковий заряд хлору більше, ніж натрію, то все колективізованих електрони сильно зрушені до ядру хлору і усуспільнення виглядає швидке як захоплення електрона більш "сильним" атомом у більш "слабкого". Останній стає, грубо кажучи, позитивним іоном, а перший - негативним, і хімічний зв'язок зводиться до тяжінню різнойменних зарядів.
Тоді що ж визначає валентність атома? Для пояснення цього розглянемо, що буде, якщо, наприклад, стрілець стріляє з гвинтівки в мішень, яка може вільно обертатися навколо цвяха, вбитого в "десятку". Потрапивши в мішень, пуля змусить її обертатися: обертальний момент кулі розподілиться між кулею і мішенню.
Нехай тепер мішень обстрілюється електронами або іншими елементарними частинками. Якщо всі вони "закручені" в одну сторону, то, поглинувши їх, мішень закрутиться. Обертання буде тим інтенсивніше, чим більше спін частинок. Електрон, наприклад, може бути "закручений" тільки двома способами: "обертання" електрона утворює або правий, або лівий гвинт з напрямком його руху. Тому, якщо спін одного електрона спрямований певним чином, то спін іншого, або паралельний йому, або антирівнобіжний.
При утворенні молекул все якраз і залежить від напрямку спінів. Так, хімічний зв'язок в молекулі водню виникає тільки тоді, коли коллектівізіруемие електрони в молекулі водню мають протилежно спрямовані спини. Все тому, що при антипаралельних спинах електрони проводять порівняно великий час між ядрами, так що середня щільність негативного заряду виявляється достатньою для врівноваження відштовхування ядер. При паралельних же спинах ця щільність мала, і ядра розштовхувати!
Але чому б трьом електронам не пов'язати відразу три ядра? Виявляється, квантова механіка накладає на рух електронів особливий заборона. Він називається принципом Паулі. Два електрона, відповідно до цього принципу, не можуть бути в одному і тому ж стані. Електрони в молекулі водню можуть відрізнятися тільки орієнтацією спінів. А можливі лише дві орієнтації. І третій електрон тут зайвий.