Кожну молекулу, іон або вільний радикал, що мають тільки локалізовані електрони, можна зобразити електронної формулою, званої структурою Льюїса, яка показує локалізацію цих електронів. B формулах Льюїса вказують тільки валентні електрони - вони можуть входити в ковалентний зв'язок або бути неподіленими. Для написання структур Льюїса використовують такі загальні правила:
1. Загальна кількість валентних електронів в молекулі (а також в іоні або радикал) повинна дорівнювати сумі всіх електронів зовнішньої оболонки, плюс позитивний заряд або мінус негативний в разі іонів.
2. неподіленого електронних (або один, або пара) складають частину зовнішньої оболонки тільки одного атома, а електрони, що беруть участь в утворенні ковалентного зв'язку, є частиною зовнішньої оболонки обох цих атомів. Атоми елементів другого періоду можуть мати не більше восьми валентних електронів (правило октету). У тих випадках, коли можлива побудова структур, з числом валентних електронів у атомів або менше восьми, або вісім, реалізуються структури з октетом електронів, тому що вони мають більш низьку енергію. Наприклад, етилен має структуру
Молекула кисню має структуру бірадікал з більш низькою енергією, ніж структура з подвійним зв'язком, однак і в цьому випадку у кожного атома кисню присутній по вісім електронів так як неспарені електрони розташовуються на загальних для обох атомав -МО, тобто правило октету зберігається.
3. Зазвичай для кожного атома вказують формальний заряд. При цьому передбачається, що атом володіє всіма неспареними електронами, але тільки половиною електронів, що беруть участь в утворенні ковалентного зв'язку. Надлишок належать атому електронів обумовлює негативний заряд, а недолік - позитивний.
електронегативність
Електронне хмара, що зв'язує два однакових атома, симетрично (щодо площині міжмолекулярної зв'язку і розділяє її навпіл), у всіх інших випадках електронна щільність зміщена в більшій мірі до одного з них. Такого роду тяжіння називають електронегативні. Кажуть, що атом, до якого зміщена електронна щільність в більшій мірі, є більш електронегативний. Електронегативність атомів залежить від їх природи, оточення і гібридизації. Існують різні кількісні характеристики електронегативності. Найбільш відома шкала Полінга, заснована на енергіях зв'язку двоатомних молекул. Енергію зв'язку А-В приймають як середньоарифметичне від енергії зв'язку молекул А -А і В -В. Отримана таким чином електронний торгівельний буде відносної. За стандарт приймають електронегативність самого електронегативного елемента - фтору. У цій шкалі атому фтору була приписана електронний торгівельний, рівна 4. А електронний торгівельний будь-якого елементу отримують з різниці між справжньою енергією зв'язку А-В і середнім арифметичним значенням енергій зв'язку А -А і В -В за формулою (різниця позначають ):
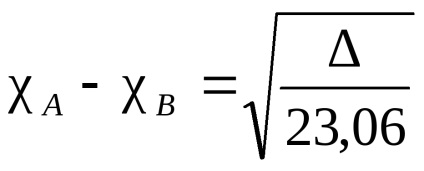
де
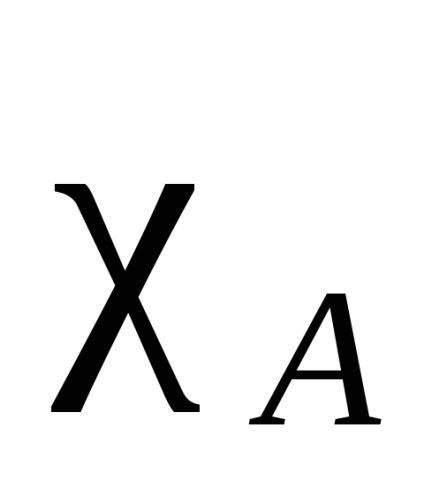
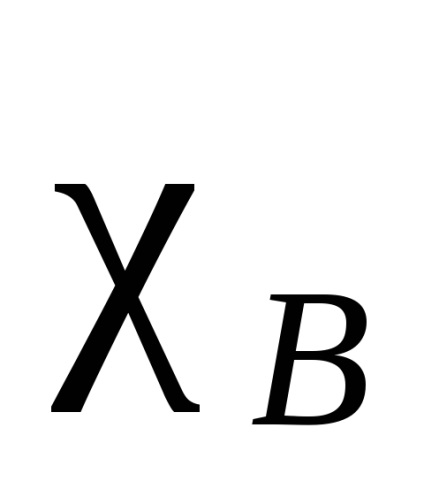
Інші підходи засновані на інших принципах. У деяких з цих підходів можна розрахувати електронегативності для різних валентних станів, різних гібридизації (sр -вуглецевого атом більш електроотріцателен, ніж sp 2. який в свою чергу більш електроотріцателен, ніж sp 3), а також первинного, вторинного і третинного вуглецевих атомів. Крім того, можна розрахувати електронегативності не тільки для атомів, але і для груп (табл.1).
Таблиця 1. Електронегативність вуглецю в залежності від оточення і гібридизації.