Квантово-механічні розрахунки показують, що в багатоелектронних атомах енергія електронів одного рівня неоднакова, електрони заповнюють атомні орбіталі різних видів і мають різну енергію. Кожен енергетичний рівень, крім першого, розщеплюється на таке число енергетичних підрівнів, скільки видів орбіталей включає цей рівень. Другий енергетичний рівень розщеплюється на два підрівні (2s і 2р-підрівні), третій енергетичний рівень - на три підрівні (3s, 3р- і 3d-підрівні) і т. Д. Розщеплення другого, третього і четвертого енергетичних рівнів показано на рис. 9.
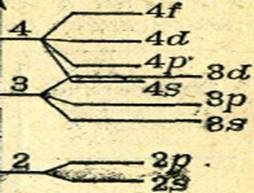
Кожен s-підрівень містить одну s-AО, кожен p-підрівень - три р-АТ, кожен d-підрівень - п'ять d-АО і кожен f-підрівень - сім f-АТ.
Енергетичний рівень характеризується головним квантовим числом n. Для всіх відомих елементів значення n змінюються від 1 до 7. Електрони в багатоелектронних атомі, що знаходиться в основному (не збудженому) стані, займають енергетичні рівні від першого до сьомого.
Енергетичний підрівень характеризується орбітальним квантовим числом l. Для кожного рівня (n = const) квантове число l приймає всі цілочисельні значення від 0 до (n - 1), наприклад, при n = 3 значеннями l будуть 0, 1 і 2. Орбітальний квантове число визначає геометричну форму орбіталей.
Закономірність заповнення електронних оболонок атомів визначається принципом заборони, встановленим в 1925 р швейцарським фізиком Паулі (принцип заборони Паулі): в атомі не можуть одночасно перебувати два електрона в тотожних станах.
Два електрона, що займають в атомі різні енергетичні рівні і підрівні, знаходяться в різних квантово-механічних станах. Різниця електронів, що займають різні атомні орбіталі одного підрівня (n = const), крім s-підрівні, характеризується магнітним квантовим числом ml. Це число називається магнітним, оскільки воно характеризує поведінку електронів в зовнішньому магнітному полі. Якщо значення l визначає геометричну форму атомних орбіталей підрівні, то значення квантового числа встановлює взаємне просторове розташування цих орбіталей.
Магнітне квантове число ml в межах даного підрівня вживає всіх цілочисельні значення від + l до -l, включаючи нуль. Для s-підрівні ml = 0.
Для р-підрівні ml може приймати три значення +1, 0, -1.
Таким чином, кожна атомна орбіталь однозначно визначається трьома квантовими числами.
Поєднання трьох квантових чисел, що характеризують конкретну атомну орбіталь, вибирається з ансамблю всіх можливих значень квантових чисел.
З причини того, що кожна орбіталь може максимально заповнюватися двома електронами, число електронів, яке може розміститися на кожному енергетичному рівні і підрівні, вдвічі більше числа орбіталей на даному рівні або підрівні. Оскільки електрони, що знаходяться в одній атомній орбіталі, мають однакові значення квантових чисел n, l і ml. то для відмінності двох електронів - на одній орбіталі використовується четверте, спінові квантове число ms. яке визначається спіном електрона. Відповідно c принципом Паулі можна стверджувати, що кожен електрон в атомі однозначно характеризується своїм набором чотирьох квантових чисел.
Заселення електронами енергетичних рівнів, підрівнів і атомних
орбіталей підпорядковується наступним правилом: в збудженому атомі всі електрони володіють найменшою енергією.
Заповнення атомних орбіталей всередині одного енергетичного підрівня відбувається відповідно до правила, сформульованим німецьким фізиком Ф. Хунду (1927 г.) (правило Хунда): атомні орбіталі, що належать до одного подуровню, заповнюються кожна спочатку одним електроном, а потім відбувається їх заповнення другими електронами .