Розгляд елементів ми почнемо з головної підгрупи сьомої групи - галогенів, які є типовими неметалами
§ 35. Особливості атомної і молекулярної структури галогенів
Елементи групи галогенів дуже подібні за властивостями, тому розглядаються разом. Дещо відмінний від інших фтор. «Галогени» в перекладі означає «солероди». Дійсно, всі галогени - фтор F, хлор Сl, бром Вr і йод I - при безпосередній взаємодії з металами утворюють солі. Галогеном є і астат At, відкритий в 1940 р
Електронні конфігурації галогенів: F - 1s 2 2s 2 2p 5; Cl - 1s 2 2s 2 2p 6 3s 2 3p 5; Br - 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 5; I - 1s 2 s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 2 5p 5.
Розподіл електронів по енергетичним рівням галогенів залежно від заряду ядра Таблиця 11
Розподіл по орбиталям електронів зовнішнього електронного шару у всіх галогенів однотипне
Галогени мають багато спільного в будові атомів і молекул. У них завершується забудова р -оболонки зовнішнього шару, тому всі вони належать до числа р-елементів. Зовнішньому електронного шару атомів галогенів бракує до завершення одного електрона, тому електронний торгівельний у цих елементів виражена яскраво і в окисно-відновних реакціях вони поводяться в основному як окислювачі.
Молекули галогенів складаються з д вух атомів (F2, Сl2, Вr2, l2), з'єднаних між собою за допомогою ковалентного неполярной зв'язку. Між атомами в молекулах галогенів виникає одна загальна електронна пара. Це свідчить про те, що в простих речовинах дані елементи одновалентних. Кристалічна решітка галогенів молекулярного типу.
Атоми різних галогенів розрізняються числом електронних шарів, в зв'язку з чим радіуси атомів галогенів різні (табл. 11). Із зростанням зарядів ядер радіуси атомів збільшуються, що веде до поступового зменшення величини електронегативності від фтору до йоду і зниження неметаллічності властивостей. Найбільш яскраво вираженим неметаллом серед галогенів є фтор, найменш яскравим - йод.
■ 1. Як змінюється величина атомного радіусу в залежності від зростання заряду ядра атома?
2. Якого типу хімічний зв'язок в молекулах галогенів?
3. Якого типу кристалічна решітка у галогенів?
4. Яка валентність галогенів у вільному стані?
5. Чому при утворенні молекули галогену між атомами виникає лише одна електронна пара?
6. Як змінюється величина електронегативності зі зростанням радіусів атомів? (Див. Відповідь)
§ 36. Фізичні властивості галогенів
Всі властивості галогенів, як фізичні, так і хімічні, залежать від будови атомів елементів. Ці властивості різних галогенів багато в чому схожі, але в той же час кожному галогенні притаманний ряд особливостей.
Фтор - газ світло-зеленого кольору, що відрізняється надзвичайно отруйними властивостями. Температура кипіння фтору -188 °, температура затвердіння -218 °. Щільність 1,11 г / см'.
Хлор - газ жовто-зеленого кольору. Він також отруйний, має різкий, задушливий, неприємний запах. Хлор важчий за повітря, порівняно добре розчиняється в воді (на 1 об'єм води 2 обсягу хлору), утворюючи хлорне воду; Cl2agi при температурі-34 ° перетворюється в рідину, а при- 101 ° твердне. Щільність 1,568 г / см3 ..
Бром-єдиний рідкий неметалл. Ця речовина червоно-бурого кольору, важке, летюча. Посудина, в якому знаходиться бром, завжди забарвлений його парами в червоно-бурий колір.
Бром має важкий неприємний запах ( «бром» в перекладі на російську мову означає «смердючий»). У воді розчиняється погано, утворюючи бромную воду Br2aq. Набагато краще бром розчиняється в органічних розчинниках - бензолі, толуолі, хлороформі.
Якщо до бромної воді долити невелику кількість бензолу і гарненько збовтати, то після розшаровування рідин можна помітити, як забарвлення бромної води зникає, а зібрався нагорі бензол забарвлюється розчиненим бромом в яскраво-оранжевий колір. Це пояснюється тим, що бензол витягнув з води бром внаслідок його кращої розчинності в бензолі.
Зберігають бром в склянках з притертими пробками і притертими ковпаками. Гумові пробки для роботи з бромом, як і для роботи з хлором, незастосовні, так-як вони швидко роз'їдаються. Бром набагато важча за воду (щільність 3,12 г / см 3). Температура кипіння брому 63 °, температура затвердіння -7,3 °.
Йод - речовина кристалічна, темно-сірого кольору, в парах - фіолетового. Щільність йоду 4,93 г / см3, температура плавлення 113 °, температура кипіння 184 °. Довести йод до плавлення, а тим більше до кипіння при звичайних умовах не вдається, тому що вже при слабкому нагріванні він з твердого стану відразу переходить в пар -возгоняется. Перехід речовини з твердого стану в газоподібний, оминаючи рідкий, і назад називається сублімацією. Ця властивість характерна не тільки для йоду, а й для деяких інших речовин. Його зручно використовувати для очищення речовин від домішок.
Йод погано розчиняється у воді. Забарвлення йодної води I2aq завжди світло-жовта. Але зате він прекрасно розчиняється в спирті. Цим користуються для приготування 5-10% розчину йоду в спирті, званого йодною настойкою. Йод розчиняється також в бензолі, толуолі, ефірі, сірковуглецю та інших органічних розчинниках. Цікаво, що йод дуже добре розчиняється в розчині власних солей, наприклад в йодистим калії. Цей розчин, званий розчином Люголя, широко застосовується в клінічних лабораторіях.
Якщо в йодну воду I2aq додати трохи бензолу, то при струшуванні на поверхні також утворюється забарвлене бензольне кільце, але тільки малинового кольору.
■ 7. Як змінюється інтенсивність забарвлення галогенів зі зростанням зарядів ядер?
8. Яку назву мають розчини хлору, брому та йоду у воді?
9. Як змінюється щільність галогенів зі зростанням зарядів ядер? (Див. Відповідь)
10. Складіть і заповніть таблицю «Фізичні властивості галогенів» за таким зразком:
11. Як пояснити з точки зору будови кристалічної решітки низькі температури плавлення і кипіння галогенів?
12. Яка відносна щільність фтору і хлору в повітрі і водню? Якщо ви не знаєте, що таке відносна густина газів, як вона визначається і як нею користуватися при розрахунках, зверніться до додатка II, стор. 387. Після цього ви зможете відповісти на питання.
13. Який об'єм займуть 20 кг хлору при нормальних умовах? Якщо ви забули, як обчислювати обсяг газу при нормальних умовах, зверніться до додатка. (Див. Відповідь)
§ 37. Фізіологічна дія галогенів
Всі галогени отруйні за своїм фізіологічною дією. Особливо отруйний фтор: при вдиханні в невеликих кількостях він викликає набряк легенів, у великих - руйнування легеневої тканини і смерть.
Хлор - також речовина дуже отруйна, хоча в дещо меншій мірі. Під час першої світової війни він застосовувався як бойова отруйна речовина, тому що він важчий за повітря і добре утримується над поверхнею землі, особливо при безвітряної погоди. Гранично допустима концентрація вільного хлору в повітрі 0,001 мг / л.
Хронічне отруєння хлором викликає зміну кольору обличчя, легеневі та бронхіальні захворювання. При отруєння хлором в якості протиотрути потрібно застосовувати суміш парів спирту з ефіром, а також водяної пари з домішкою нашатирного спирту, причому попередньо обов'язково винести потерпілого на свіже повітря.
У невеликих же кількостях хлор може виліковувати захворювання верхніх дихальних шляхів, так як згубно діє на бактерії. Завдяки дезінфікуючій дії хлор застосовується для знезараження водопровідної води.
Пари брому викликають задуху. Отруйний і рідкий бром, заподіює при попаданні на шкіру сильні опіки. Переливати бром з однієї судини в іншій рекомендується в гумових рукавичках і під тягою.
При попаданні на шкіру бром слід змивати органічним розчинником - бензолом або чотирьоххлористим вуглецем, протираючи уражене місце ватою, змоченою цими розчинниками. При змиванні брому водою нерідко опіку уникнути не вдається.
Йод найменш отруйний з усіх галогенів. Вдихання парів йоду при його нагріванні може викликати отруєння, але працювати з пароподібним йодом доводиться рідко, наприклад при очищенні його сублімацією. Кристалічний йод руками брати не слід, так як при попаданні на шкіру він викликає поява характерних жовтих плям. Всі роботи з галогенами слід проводити у витяжній шафі.
Разом з тим галогени є життєво важливими елементами. Хлор у вигляді кухонної солі постійно застосовується в їжу, а також входить до складу зеленого речовини рослин - хлорофілу. Недолік сполук фтору в питній воді викликає руйнування зубів. Йод необхідний всім живим організмам, як рослинним, так і тваринам. Він бере участь в регулюванні обміну речовин. В організмі людини йод зосереджений головним чином у щитовидній залозі і бере участь в утворенні її гормону. Недолік йоду викликає хворобливі зміни щитовидної залози. Для запобігання захворювання в їжу в дуже невеликих кількостях додають йод, розводячи кілька крапель йодної настоянки на склянку води, але частіше у вигляді йодиду натрію і йодиду калію.
• Запишіть в зошит заходи техніки безпеки в роботі з галогенами і першої допомоги при отруєннях.
§ 38. Хімічні властивості галогенів
За характером хімічних властивостей, як зазначено вище, все галогени є типовими неметалами, що володіють значною електронегативність. Найбільш електронегативним елементом, що володіє найбільшою неметалевої активністю, є фтор, найменш активний йод.
Взаємодія галогенів з простими речовинами. Простежити зменшення хімічної активності від фтору до хлору можна на прикладах різних реакцій. Особливо цікаво взаємодія різних галогенів з воднем. Умови реакцій у них при цьому різні.
Так, фтор реагує з воднем з вз ривом навіть в темряві. При цьому утворюється фтористий водень за рівнянням.
H2 + F2 = 2HF
Фтористий водень є найбільш міцним з'єднанням серед галогеноводородов.
Взаємодія хлору з воднем відбувається з вибухом тільки на світлі:
Сl2 + Н2 = 2НСl
Якщо ж підпалити струмінь водню в атмосфері хлору, то він буде згоряти спокійно безбарвним полум'ям (рис. 21).
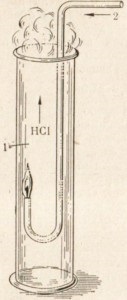
Мал. 21. Горіння водню в хлорі.
1 хлор
2 водень
З воднем бром утворює бромистий водень.
Вr2 + Н2 = 2НВг
Процес йде при слабкому нагріванні.
Йод з воднем реагує тільки при нагріванні з утворенням йодистого водню:
Н2 + I2 = 2НI
Однак це з'єднання дуже нестійкий і легко розпадається з утворенням водню і йоду. У всіх цих випадках галогени поводяться як окислювачі. Галогено-водень при розчиненні у воді утворюють кислоти.
Окисні властивості галогени виявляють і при взаємодії з металами, яке протікає зазвичай дуже активно.
Фтор реагує практично майже з усіма металами. Легко простежити взаємодію х т о к р а з металами. Багато метали в хлорі горять, наприклад сурма самозаймається (рис. 22). Інші метали реагують з хлором при нагріванні, наприклад натрій (рис. 23).
2Na + Сl2 = 2NaCl
Якщо метали можуть мати різну ступінь окислення, то при реакції з хлором вони зазвичай виявляють високу. Наприклад.
2Fe + 3Сl2 = 2FeCl3
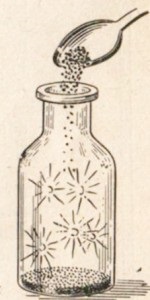
Мал. 22. Самовоспламенение сурми в хлорі
Тут залізо в реакції з хлором проявляє ступінь окислення, рівну +3 - Fe +3. а мідь рівну + 2 Cu +2. У всіх наведених випадках хлор поводиться як окислювач.
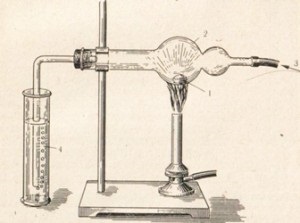
Бурхливо реагує з металами і бром. Якщо насипати в пробірку з рідким бромом трохи алюмінієвих тирси, то вони згорають в бромі з утворенням бромистого алюмінію, що супроводжується виділенням бурих парів брому і снопом іскор. Реакція йде по наступному рівнянню:
2Аl + ЗВr2 = 2АlВr3
Досвід проводиться в приладі, зображеному на рис. 24. Довга трубка 1 виконує роль повітряного холодильника. Горять в бромі також олово. сурма. а калій з бромом дає сильний вибух.
Йод також реагує з металами, утворюючи йодисті солі. Особливо цікаво відбувається реакція алюмінію з йодом. Для цього кристали йоду розтирають у ступці до утворення дрібного порошку, а потім на асбестірованной сітці змішують йод з алюмінієвим пилом. Суміш, посуд і матеріали повинні бути абсолютно сухими. Якщо після цього додати до суміші краплю води, яка є каталізатором в цьому процесі, то суміш запалюється і горить, виділяючи фіолетові клуби пари йоду
2Аl + 3I2 = 2АlI3
Мал. 23. Горіння натрію в хлорі.
1 металевий натрій
2 хлоркальцівая трубка
3 хлор
4 їдкий калій
Слід зазначити, що йод реагує з металами важче, ніж хлор і бром.
На відміну від більшості інших простих речовин галогени в безпосередню взаємодію з киснем не вступають, так як кисень і галогени мають близькими значеннями електронегативності. Разом з тим кисневі сполуки галогенів непрямим шляхом отримані і існують.
■ 14. Доведіть шляхом складання електронного балансу, що в реакціях з воднем і металами галогени поводяться як окислювачі. Обгрунтуйте така поведінка будовою атома галогенів.
15. Який обсяг хлористого водню може бути отриманий при реакції з воднем 20 л хлору? (Це завдання вирішується цілком в обсягах).
16. Для того щоб утворюється хлористий водень не містив домішок хлором, при взаємодії хлору з воднем останнього беруть на 5% більше необхідної кількості. Розрахуйте, який обсяг водню слід взяти для отримання 50 л хлористого водню. (Див. Відповідь)