Якщо ми опустимо цинкову пластинку в розчин сульфату міді, то відбудеться реакція
В результаті реакції виділиться теплота (Q). Тобто хімічна енергія перейде в теплоту. Можна перевести хімічну енергію в електричну.
Гальванічний елемент - пристрій, в якому хімічна енергія окисно-відновної реакції перетворюється в електричну енергію.
Основною відмінністю електрохімічних реакцій, що протікають в гальванічному елементі, від окислювально-восстано-вітельно реакцій є просторове розділення процесів окислення і відновлення.
Найбільш поширеним є гальванічний елемент, що складається з двох пов'язаних між собою електродів. що представляють собою металеві пластини, занурені в розчин електроліту (розчини або розплави солей з однойменною іоном).
Розглянемо роботу гальванічного елемента Даніеля-Якобі (рис. 9.5.1), що складається з двох електродів - цинкової пластини, зануреної в розчин сульфату цинку, і мідної пластини, зануреної в розчин сульфату міді. Обидва розчину стикаються один з одним, але для попередження змішування вони розділені перегородкою, виготовленої з пористого матеріалу.
При розімкнутому ланцюзі в цьому гальванічному елементі встановлюється рівновага між цинковим електродом і розчином сульфату цинку, а також між мідним електродом і розчином сульфату міді. При замиканні зовнішнього ланцюга електрони переміщаються від електрода з більш низьким потенціалом (цинкового) до електрода з більш високим потенціалом (мідному).
На цинковому електроді протікає реакція окислення, і іони переходять в розчин. Вивільняються при цьому електрони рухаються по зовнішньому ланцюзі до мідного електрода. Вся сукупність цих процесів схематично зображується рівнянням першого полуреакции
На мідному електроді протікає відновлення іонів міді: електрони, які перемістилися до нього від цинкового електрода, з'єднуються з розташованими в розчині іонами міді; утворюються атоми міді, котрі виділяються в елементної формі на пластині металу. Відповідна друга полуреакции -
Cu 2+ + 2e - = Cu 0.
Сумарне рівняння реакції, що протікає в елементі, вийде при додаванні рівнянь обох напівреакцій
Cu 2+ + 2e - + Zn 0 - 2 e - = Zn 2+ + Cu 0.
Напрямок руху іонів в розчині обумовлено протікають у електродів електрохімічними процесами. Як було згадано вище, у цинкового електрода катіони (позитивні заряджені іони) виходять в розчин, створюючи в ньому надлишковий позитивний заряд, а у мідного електрода розчин, навпаки, весь час збіднюється катіонами і заряджається негативно. В результаті цього створюється електричне поле, в якому катіони (Zn 2+ і Cu 2+) рухаються від цинкового електрода до мідного, а аніони - SO4 2- - в зворотному напрямку. В результаті рідина в обох електродів залишається електронейтральної.
Причиною виникнення і протікання електричного струму в гальванічному елементі є різниця електродних потенціалів - електрорушійна сила (ЕРС). ЕРС будь-якого гальванічного елемента дорівнює різниці потенціалів двох його електродів (катода і анода):
де Ек - електродний потенціал катода; Еа - електродний потенціал анода. ЕРС будь-якого працюючого гальванічного елемента - величина позитивна.
Анод - електрод, на якому відбувається процес віддачі електронів (окислення); в гальванічному елементі анод заряджений негативно. Катод - електрод, на якому відбувається процес приєднання електронів (відновлення); в гальванічному елементі катод заряджений позитивно.
Потенціал катода більше потенціалу анода, відповідно, в мідно-цинковій елементі цинковий електрод є анодом, а мідний - катодом.
Для елемента Даніеля-Якобі при стандартних умовах і при [Zn 2+] = [Cu 2+] = 1 моль / л
тому ЕРС = В.
Схема ланцюга гальванічного елемента записується у вигляді
(-) Zn | Zn 2+ || Cu 2+ | Cu (+)
Зліва записується анод, а праворуч - катод. Одна вертикальна риса зображує фазовий розділ між металом і розчином електроліту. Подвійна вертикальна лінія відокремлює анодное простір від катодного. В круглих дужках знаками «плюс» і «мінус» позначають полюси електродів.
Концентраційний гальванічний елемент являє собою металевий гальванічний елемент, складений з двох однакових за природою електродів, занурених у розчини своїх солей з різними концентраціями. Наприклад, срібний гальванічний елемент
Тут лівий електрод з меншою концентрацією є анодом, а правий - з більшою концентрацією - катодом.
У деяких випадках метал електрода не змінювалася в ході електродного процесу, а бере участь тільки в передачі електронів від відновленої форми речовини до його окисленої формі. Так, в гальванічному елементі
(-) Pt | Fe +2. Fe +3 || MnO4 -. Mn +2. H + | Pt (+)
роль інертних електродів грає платина. На платиновому аноді окислюється залізо (II):
а на платиновому катоді відновлюється марганець (VII):
Помноживши перше з цих рівнянь на п'ять і склавши з другим, отримуємо сумарне рівняння протікає реакції:
5Fe +2 + MnO4 - + 8H + = 5Fe +3 + Mn +2 + 4H2 O.
Відповідно до рівняння 9.3.3. можна розрахувати електродні потенціали і, відповідно, ЕРС отриманого гальванічного елемента.
Електроліз - окислювально-відновний процес, який протікає на електродах при проходженні постійного електричного струму через розчини або розплави електролітів. Сутність електролізу полягає в тому, що при пропущенні струму через розчин електроліту (або розплавлений електроліт) катіони переміщуються до негативного електроду (катоду), а аніони - до позитивного електрода (анода). Досягнувши електродів, іони розряджаються, в результаті чого у електродів виділяються складові частини розчиненого електроліту або водень і кисень з води. При електролізі протікають два паралельні процеси: на катоді (заряджений негативно) процес відновлення; на аноді (заряджений позитивно) - процес окислення. Таким чином, заряди електродів при електролізі протилежні тим, які мають місце при роботі гальванічного елемента.
На характер і протягом електродних процесів при електролізі великий вплив мають склад електроліту, розчинник, матеріал електродів і режим електролізу (напруга, щільність струму, температура і ін.). Перш за все, треба розрізняти електроліз розплавлених електролітів і розчинів.
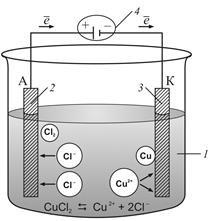
Мал. 9.6.1. Схема процесу електролізу розплаву CuCl2. 1 - розплав солі CuCl2; 2 - анод; 3 - катод; 4 - джерело постійного струму
Електроліз розплавів солей. Розглянемо як приклад електроліз розплаву хлориду міді (рис. 9.6.1). При високих температурах розплав солі дисоціюють на іони. При підключенні електродів до джерела постійного струму іони під дією електричного поля починають впорядкований рух: позитивні іони міді рухаються до катода, а негативно заряджені іони хлору - до анода.
Досягнувши катода, іони міді нейтралізуються надлишковими електронами катода і перетворюються в нейтральні атоми, які осідають на катоді:
Іони хлору, досягнувши анода, віддають електрони і утворюють молекули хлору Cl2. Хлор виділяється на аноді в вигляді бульбашок:
Сумарне рівняння окисно-відновної реакції, що відбувається при електролізі розплаву CuCl2:
Cu +2 + 2Cl - → Cu 0 +.
Електроліз водних розчинів солей. У водних розчинах, крім іонів самого електроліту, знаходяться також молекули води, здатні відновлюватися на катоді і окислюватися на аноді.
Процеси на катоді. Можливість протікання відновлення іонів металу або молекул води визначається значенням електродного потенціалу металу, а також характером середовища (рН). У загальному випадку (без впливу характеру середовища) на катоді можуть протікати наступні процеси (табл. 9.6.1):
1) якщо електролізу піддається сіль активного металу, то на катоді відновлюються молекули води. В результаті у катода виділяється водень;
2) якщо електролізу піддається сіль середньоактивних металу, то відбувається одночасне відновлення і катіонів металу, і молекул води;
3) якщо електролізу піддається сіль малоактивного металу, то на катоді відновлюються тільки катіони металу.