Це велика група речовин - вуглеводнів, які відповідають загальній формулі
де n будь-яке ціле число, не рівне 0.
Відповідний ряд алканів вивчений німецьким хіміком Карлом Шорлеммер. У вивчення конкретних представників алканів внесли свою лепту цілий ряд вчених - хіміків.
Ряд починається з найпростішого алкана - метану СН4. Познайомитися з найважливішими представниками алканів Ви можете в таблиці 2. Всі вуглеводні відрізняються один від одного на певну кількість гомологічних різниць «СН2». Відповідний ряд алканів, як і інших речовин умовно нескінченний. На сьогоднішній день відомі сполуки, що містять дуже велику кількість атомів вуглецю.
Граничні вуглеводні, як і всі члени одного гомологічного ряду, мають схожі елементами будови, принципами номенклатури і хімічними властивостями. Їх низька хімічна активність, обумовлена особливою будовою, зумовило одна з назв класу - «парафіни», що символізує їх інертність.
Алкани широко поширені в природі і мають важливе промислове значення.
2. Будова алканів:
Граничні вуглеводні, будучи насиченими, містять в своєму складі атоми вуглецю, що знаходяться в 1 валентних станів sp 3 гібридизації. При такому типі гібридизації, гібридні хмари розташовуються в просторі у формі тетраедра. (Рис. 1). Валентний кут (відстань між осями, на яких лежать електронні хмари), становить 109 градусів 28 хвилин.
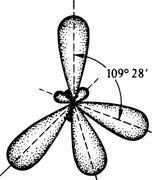
Мал. 1. Розташування електронних хмар в першому валентних станів атома вуглецю
електронні пари, в молекулах алканів немає відхилень від валентного кута. Валентність вуглецю в граничних вуглеводнях, як і у всіх інших органічних речовинах, дорівнює IV.
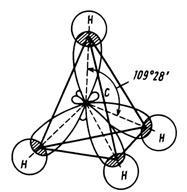
Мал. 2. Тетраедрічеськая будова молекули метану
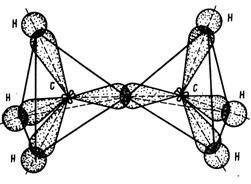
Гомологи метану, в просторі мають більш складну будову. Вершини тетраедра з'єднані. На малюнку 3 представлено електронну будову етану.
Якщо розглядати вуглеводні з більш довгим ланцюгом вуглецевих атомів, то можна помітити, що молекули алканів в просторі мають зигзагоподібну форму (рис 4).