Ковалентний хімічний зв'язок, її різновиди та механізми утворення. Характеристика ковалентного зв'язку (полярність і енергія зв'язку). Іонна зв'язок. Металева зв'язок. воднева зв'язок
Вчення про хімічний зв'язок складає основу всієї теоретичної хімії.
Під хімічним зв'язком розуміють таку взаємодію атомів, яке пов'язує їх в молекули, іони, радикали, кристали.
Розрізняють чотири типи хімічних зв'язків: іонну, ковалентний, металеву і водневу.
Розподіл хімічних зв'язків на типи носить умовний характер, по скільки всі вони характеризуються певним єдністю.
Іонну зв'язок можна розглядати як граничний випадок ковалентного полярного зв'язку.
Металева зв'язок поєднує ковалентное взаємодія атомів за допомогою обобществленних електронів і електростатичне тяжіння між цими електронами і іонами металів.
У речовинах часто відсутні граничні випадки хімічного зв'язку (або чисті хімічні зв'язки).
Наприклад, фторид літію $ LiF $ відносять до іонним з'єднанням. Фактично ж в ньому зв'язок на $ 80% $ іонна і на $ 20% $ ковалентная. Правильніше тому, очевидно, говорити про ступінь полярності (ионности) хімічного зв'язку.
В ряду галогеноводородов $ HF-HCl-HBr-HI-HАt $ ступінь полярності зв'язку зменшується, бо зменшується різниця в значеннях електронегативності атомів галогену і водню, і в астатоводень зв'язок стає майже неполярной $ (ЕО (Н) = 2.1; ЕО (At) = 2.2) $.
Різні типи зв'язків можуть міститися в одних і тих же речовинах, наприклад:
- в підставах: між атомами кисню і водню в гидроксогрупп зв'язок полярна ковалентний, а між металом і гидроксогрупп - іонна;
- в солях кисневмісних кислот: між атомом неметалла і киснем кислотного залишку - ковалентний полярна, а між металом і кислотним залишком - іонна;
- в солях амонію, метіламмонія і т. д. між атомами азоту і водню - ковалентний полярна, а між іонами амонію або метіламмонія і кислотним залишком - іонна;
- в пероксид металів (наприклад, $ Na_2O_2 $) зв'язок між атомами кисню ковалентная неполярная, а між металом і киснем - іонна і т.д.
Різні типи зв'язків можуть переходити одна в іншу:
- при електролітичноїдисоціації в воді ковалентних сполук ковалентная полярна зв'язок переходить в іонну;
- при випаровуванні металів металева зв'язок перетворюється в ковалентну неполярну і т.д.
Причиною єдності всіх типів і видів хімічних зв'язків служить їх однакова хімічна природа - електронно-ядерна взаємодія. Утворення хімічного зв'язку в будь-якому випадку є результат електронно-ядерної взаємодії атомів, що супроводжується виділенням енергії.
Способи утворення ковалентного зв'язку. Характеристики ковалентного зв'язку: довжина і енергія зв'язку
Ковалентний хімічний зв'язок - це зв'язок, що виникає між атомами за рахунок утворення спільних електронних пар.
Механізм утворення такого зв'язку може бути обмінним і донорно-акцепторні.
I. Обмінний механізм діє, коли атоми утворюють загальні електронні пари за рахунок об'єднання неспарених електронів.
Зв'язок виникає завдяки освіті загальної електронної пари $ s $ -Електронна атомів водню (перекривання $ s $ -орбіталей):
2) $ HCl $ - хлороводень:
Зв'язок виникає за рахунок утворення спільної електронної пари з $ s- $ і $ p- $ електронів (перекривання $ s-p- $ орбіталей):
3) $ Cl_2 $: в молекулі хлору ковалентний зв'язок утворюється за рахунок непарних $ p- $ електронів (перекривання $ p-p- $ орбіталей):
4) $ N_2 $: в молекулі азоту між атомами утворюються три загальні електронні пари:
II. Донорно-акцепторні механізм утворення ковалентного зв'язку розглянемо на прикладі іона амонію $ NH_4 ^ + $.
Донор має електронну пару, акцептор - вільну орбіталь, яку ця пара може зайняти. В іоні амонію всі чотири зв'язку з атомами водню ковалентні: три утворилися завдяки створенню спільних електронних пар атомом азоту і атомами водню за обмінним механізмом, одна - по донорно-акцепторного механізму.
Ковалентні зв'язки можна класифікувати за способом перекривання електронних орбіталей, а також щодо зміщення їх до одного з пов'язаних атомів.
Хімічні зв'язки, що утворюються в результаті перекривання електронних орбіталей вздовж лінії зв'язку, називаються $ σ $ -зв'язків (сигма-зв'язками). Сигма-зв'язок дуже міцна.
$ P- $ Орбіталі можуть перекриватися в двох областях, утворюючи ковалентний зв'язок за рахунок бічного перекривання:
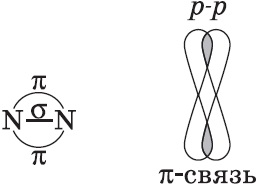
Хімічні зв'язки, що утворюються в результаті «бічного» перекривання електронних орбіталей поза лінією зв'язку, тобто в двох областях, називаються $ π $ -зв'язків (пі-зв'язками).
За ступенем зміщених загальних електронних пар до одного з пов'язаних ними атомів ковалентний зв'язок може бути полярної і неполярний.
Ковалентну хімічний зв'язок, що утворюється між атомами з однаковою електронегативністю, називають неполярной. Електронні пари не зміщені до жодного з атомів, тому що атоми мають однакову ЕО - властивість відтягувати до себе валентні електрони від інших атомів. наприклад:
тобто за допомогою ковалентного неполярной зв'язку утворені молекули простих речовин-неметалів. Ковалентну хімічний зв'язок між атомами елементів, електронегативності яких відрізняються, називають полярною.
Довжина і енергія ковалентного зв'язку.
Характерні властивості ковалентного зв'язку - її довжина і енергія. Довжина зв'язку - це відстань між ядрами атомів. Хімічна зв'язок тим міцніше, чим менше її довжина. Однак мірою міцності зв'язку є енергія зв'язку. яка визначається кількістю енергії, необхідної для розриву зв'язку. Зазвичай вона вимірюється в кДж / моль. Так, згідно з досвідченим даними, довжини зв'язку молекул $ H_2, Cl_2 $ і $ N_2 $ відповідно становлять $ 0.074, 0.198 $ і $ 0.109 $ нм, а енергії зв'язку відповідно рівні $ 436, 242 $ і $ 946 $ кДж / моль.
Іони. іонна зв'язок
Уявімо собі, що «зустрічаються» два атома: атом металу I групи і атом неметалла VII групи. У атома металу на зовнішньому енергетичному рівні знаходиться єдиний електрон, а атому неметалла якраз не вистачає саме одного електрона, щоб його зовнішній рівень виявився завершеним.
Перший атом легко віддасть другого свій далекий від ядра і слабо пов'язаний з ним електрон, а другий надасть йому вільне місце на своєму зовнішньому електронному рівні.
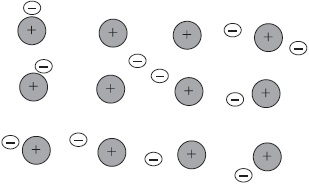
Тоді атом, позбавлений одного свого негативного заряду, стане позитивно зарядженою часткою, а другий перетвориться в негативно заряджену частинку завдяки отриманому електрону. Такі частинки називаються іонами.
Хімічна зв'язок, що виникає між іонами, називається іонної.
Розглянемо освіту зв'язку з цим на прикладі добре всім знайомого з'єднання хлориду натрію (кухонна сіль):
Процес перетворення атомів в іони зображений на схемі:
Таке перетворення атомів в іони відбувається завжди при взаємодії атомів типових металів і типових неметалів.
Розглянемо алгоритм (послідовність) міркувань при записі освіти іонної зв'язку, наприклад між атомами кальцію і хлору:
- Кальцій - це елемент головної підгрупи II групи, метал. Його атому легше віддати два зовнішніх електрона, ніж прийняти відсутні шість: $ ↙-2e↖ → Ca ^ ↙ $.
- Хлор - це елемент головної підгрупи VII групи, неметалл. Його атому легше прийняти один електрон, якого йому не вистачає до завершення зовнішнього рівня, ніж віддати сім електронів з зовнішнього рівня: $ ↙ + 1e↖ → Cl ^ ↙ $.
- Спочатку знайдемо найменше спільне кратне між зарядами утворилися іонів, воно дорівнює $ 2 (2 · 1) $. Потім визначимо, скільки атомів кальцію потрібно взяти, щоб вони віддали два електрона, тобто треба взяти один атом $ Са $, і скільки атомів хлору треба взяти, щоб вони могли прийняти два електрона, тобто потрібно взяти два атома $ Cl $.
- Схематично освіту іонної зв'язку між атомами кальцію і хлору можна записати так:
Цифри, що показують число атомів або молекул, називаються коефіцієнтами. а цифри, що показують число атомів або іонів в молекулі, називають індексами.
металева зв'язок
Ознайомимося з тим, як взаємодіють між собою атоми елементів-металів. Метали зазвичай існують не у вигляді ізольованих атомів, а в формі шматка, злитка або металевого виробу. Що утримує атоми металу в єдиному обсязі?
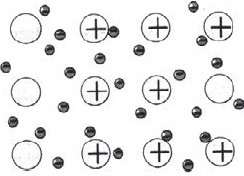
Атоми більшості металів на зовнішньому рівні містять невелику кількість електронів - $ 1, 2, 3 $. Ці електрони легко відриваються, і атоми при цьому перетворюються в позитивні іони. Відірвалися електрони переміщаються від одного іона до іншого, пов'язуючи їх в єдине ціле. З'єднуючись з іонами, ці електрони утворюють тимчасово атоми, потім знову відриваються і з'єднуються вже з іншим іоном і т.д. Отже, в обсязі металу атоми безперервно перетворюються в іони і навпаки.
Зв'язок в металах між іонами за допомогою обобществленних електронів називається металевої.
На малюнку схематично зображено будову фрагмента металу натрію.
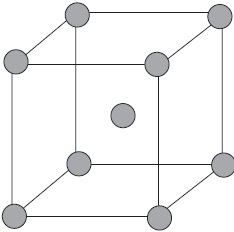
При цьому невелике число обобществленних електронів пов'язує велику кількість іонів і атомів.
Металева зв'язок має деяку схожість з ковалентним, оскільки заснована на усуспільнення зовн них електронів. Однак при ковалентного зв'язку усуспільнено зовнішні непарні електрони тільки двох сусідніх атомів, в той час як при металевої зв'язку в усуспільнення цих електронів беруть участь всі атоми. Саме тому кристали з ковалентним зв'язком крихкі, а з металевої, як правило, пластичні, електропровідні і мають металевий блиск.
Металева зв'язок характерна як для чистих металів, так і для сумішей різних металів - сплавів, що знаходяться в твердому і рідкому станах.
воднева зв'язок
Хімічний зв'язок між позитивно поляризованими атомами водню однієї молекули (або її частини) та негативно поляризованими атомами сильно електронегативний елементів, що мають неподіленого електронні пари ($ F, O, N $ і рідше $ S $ і $ Cl $), інший молекули (або її частини) називають водневої.
Механізм утворення водневого зв'язку має частково електростатичний, частково донорно- акцепторні характер.
Приклади міжмолекулярної водневого зв'язку:
При наявності такого зв'язку навіть низькомолекулярні речовини можуть бути при звичайних умовах рідинами (спирт, вода) або легко зріджується газами (аміак, фтороводород).
Речовини з водневим зв'язком мають молекулярні кристалічні решітки.
Речовини молекулярного і немолекулярного будови. Тип кристалічної решітки. Залежність властивостей речовин від їх складу і будови
Молекулярне і немолекулярное будова речовин
В хімічні взаємодії вступають не окремі атоми або молекули, а речовини. Речовина при заданих умовах може перебувати в одному з трьох агрегатних станів: твердому, рідкому або газоподібному. Властивості речовини залежать також від характеру хімічного зв'язку між утворюють його частинками - молекулами, атомами або іонами. За типом зв'язку розрізняють речовини молекулярного і немолекулярного будови.
Речовини, що складаються з молекул, називаються молекулярними речовинами. Зв'язки між молекулами в таких речовинах дуже слабкі, набагато слабкіше, ніж між атомами всередині молекули, і вже при порівняно низьких температурах вони розриваються - речовина перетворюється в рідину і далі в газ (сублімація йоду). Температури плавлення і кипіння речовин, що складаються з молекул, підвищуються зі збільшенням молекулярної маси.
До молекулярним речовин відносяться речовини з атомною структурою ($ C, Si, Li, Na, K, Cu, Fe, W $), серед них є метали і неметали.
Розглянемо фізичні властивості лужних металів. Відносно мала міцність зв'язку між атомами зумовлює низьку механічну міцність: лужні метали м'які, легко ріжуться ножем.
Великі розміри атомів призводять до малої щільності лужних металів: літій, натрій і калій навіть легше води. У групі лужних металів температури кипіння і плавлення знижуються зі збільшенням порядкового номера елемента, тому що розміри атомів збільшуються, і слабшають зв'язку.
До речовин немолекулярного будови відносяться іонні сполуки. Таким будовою володіє більшість з'єднань металів з неметалами: все солі ($ NaCl, K_2SO_4 $), деякі гідриди ($ LiH $) і оксиди ($ CaO, MgO, FeO $), підстави ($ NaOH, KOH $). Іонні (немолекулярное) речовини мають високі температури плавлення і кипіння.
кристалічні решітки
Речовина, як відомо, може існувати в трьох агрегатних станах: газоподібному, рідкому і твердому.
Тверді речовини: аморфні і кристалічні.
Розглянемо, як впливають особливості хімічних зв'язків на властивості твердих речовин. Тверді речовини діляться на кристалічні і аморфні.
Аморфні речовини не мають чіткої температури плавлення - при нагріванні вони поступово розм'якшуються і переходять в текучий стан. У аморфному стані, наприклад, знаходяться пластилін і різні смоли.
Кристалічні речовини характеризуються правильним розташуванням тих частинок, з яких вони складаються: атомів, молекул та іонів - у строго визначених точках простору. При з'єднанні цих точок прямими лініями утворюється просторовий каркас, званий кристалічною решіткою. Точки, в яких розміщені частинки кристала, називають вузлами решітки.
Залежно від типу частинок, розташованих у вузлах кристалічної решітки, і характеру зв'язку між ними розрізняють чотири типи кристалічних решіток: іонні, атомні, молекулярні і металеві.
Іонні кристалічні решітки.
Іонними називають кристалічні решітки, у вузлах яких знаходяться іони. Їх утворюють речовини з іонним зв'язком, якій можуть бути пов'язані як прості іони $ Na ^, Cl ^ $, так і складні $ SO_4 ^, ОН ^ - $. Отже, іонними кристалічними гратами мають солі, деякі оксиди і гідроксиди металів. Наприклад, кристал хлориду натрію складається з чергуються позитивних іонів $ Na ^ + $ і негативних $ Cl ^ - $, які утворюють решітку у формі куба. Зв'язки між іонами в такому кристалі дуже стійкі. Тому речовини з іонним гратами відрізняються порівняно високою твердістю і міцністю, вони тугоплавкі і нелеткі.
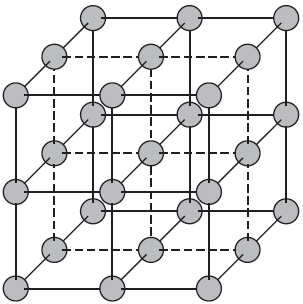
Атомні кристалічні решітки.
Атомними називають кристалічні решітки, у вузлах яких знаходяться окремі атоми. У таких решітках атоми з'єднані між собою дуже міцними ковалентними зв'язками. Прикладом речовин з таким типом кристалічних решіток може служити алмаз - одне з аллотропних видозмін вуглецю.
Більшість речовин з атомної кристалічною решіткою мають дуже високі температури плавлення (наприклад, у алмазу вона вище $ 3500. ° С $), вони міцні і тверді, практично нерозчинні.
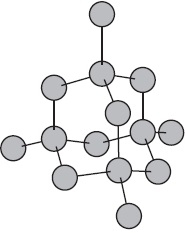
Молекулярні кристалічні решітки.
Молекулярними називають кристалічні решітки, у вузлах яких розташовуються молекули. Хімічні зв'язку в цих молекулах можуть бути і полярними ($ HCl, H_2O $), і неполярними ($ N_2, O_2 $). Незважаючи на те, що атоми всередині молекул пов'язані дуже міцними ковалентними зв'язками, між самими молекулами діють слабкі сили міжмолекулярної тяжіння. Тому речовини з молекулярними кристалічними гратами мають малу твердість, низькі температури плавлення, летючі. Більшість твердих органічних сполук мають молекулярні кристалічні решітки (нафталін, глюкоза, цукор).

Металеві кристалічні решітки.
Речовини з металевою зв'язком мають металеві кристалічні решітки. У вузлах таких грат знаходяться атоми і іони (то атоми, то іони, в які легко перетворюються атоми металу, віддаючи свої зовнішні електрони «в загальне користування»). Таке внутрішню будову металів визначає їх характерні фізичні властивості: гнучкість, пластичність, електро- і теплопровідність, характерний металевий блиск.