Важливим етапом будь-якого иммуногистохимического методу є візуалізація результатів реакції «антиген-антитіло». Виявити антитіла, зв'язалися з антигеном, можна використовуючи різні мітки, пов'язані з Fc-фрагментом антитіл. Такими позначки можна використати:
Однак, флюоресцентні мітки мають свої недоліки:
Тому в подальшому були розроблені методи отримання стабільних забарвлень, щоб препарати можна було досліджувати за допомогою звичайної світлової мікроскопії і довго зберігати.
Найбільш простий міткою для отримання препаратів з тривалим терміном зберігання є метали, наприклад, колоїдне золото. В результаті реакції «антиген-антитіло» в місці скупчення антитіл в світловому мікроскопі виявляється фарбування в темний колір. Довгий час мічені металами антитіла використовувалися рідко через низьку чутливості, однак в 1989 році чутливість була підвищена в 100 раз за допомогою методу посилення сріблом і мікроскопії в поляризованому світлі [7]. У рідкісних випадках використовуються антитіла, мічені важкими металами для подальшого електронно-мікроскопічного дослідження препаратів.
Радіоізотопи також використовуються дуже рідко через високу небезпеку опромінення персоналу. Мічені радіоактивними мітками антитіла в даний момент використовуються тільки для досліджень на живих культурах клітин. Після обробки культури тканини антитілами з радіоактивними мітками за ступенем випромінювання можна судити про кількість шуканого антигену в тканинах.
Найбільшого поширення набули ферментні мітки [4]. Одна молекула ферменту, кон'юговані з антитілом, здатна «обробити» велику кількість молекул субстрату, що утворився нерозчинний барвник накопичується в тканині навколо фіксованого до антигену антитіла.
Таблиця 1. Характеристики найбільш часто використовуваних флюорохромів.
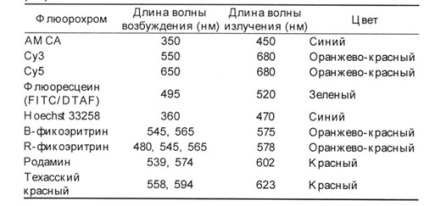
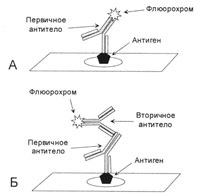
Рис 1. Прямий і непрямий метод візуалізації
А - первинне антитіло проти антигену містить мітку, наприклад, флюорохром. Б - первинне антитіло проти антигену не має мітки, після інкубації з первинним антитілом додають вторинне антитіло, яке з'єднується з первинним. Мітка знаходиться на вторинному антитілі.
Рис 2. Кінцевий комплекс, що утворюється при РАР-методі.
Первинне антитіло і антитіло проти пероксидази в РАР-комплексі повинні бути отримані від тварин одного і того ж виду.
Найбільшого поширення в якості ферментної мітки отримали пероксидаза хрону, яку вперше застосували Накане і Пірс, лужна фосфатаза і глюкозоксидаза. Для кожного із зазначених ферментів існує кілька субстратів, які під дією ферменту утворюють нерозчинні фарбники різного кольору. Можливі поєднання ферментів і субстратів підсумовані в таблиці 2.
Необхідно пам'ятати, що пероксидаза і лужна фосфатаза є і в тканинах організму, тому іноді можна отримати хибнопозитивні результати [2,3]. Пероксидаза міститься у великій кількості в нейтрофілах і еозинофілів, тому для фарбування мазків крові, кісткового мозку і зрізів імунокомпетентних органів використання цього ферменту не рекомендується. При фарбуванні інших тканин невелика пероксидазна активність блокується додаванням перекису водню перед інкубацією з первинними антитілами. Лужна фосфатаза міститься в багатьох тканинах, тому під час інкубації з субстратом в нього додають левамизол, однак треба пам'ятати, що лужна фосфатаза кишечника і плаценти не пригнічує левамизолом, тому для цих тканин краще використовувати інші ферменти. Глюкозоксидаза може використовуватися без обмежень при фарбуванні будь-яких тканин, тому що в тканинах ссавців немає такого ферменту.
Відкриття ферментних міток стало великим кроком вперед при розробці иммуногистохимических технологій, проте всі проблеми не були вирішені. При дослідженні антигенів, які містяться в невеликій кількості в клітинах (наприклад, рецепторів до гормонів на клітинної поверхні, іонних каналів) чутливість даних систем була явно недостатньою.
Наступним кроком у розвитку систем візуалізації стали системи з використанням антитіл проти пероксидази і лужної фосфатази (PAP і APAAP-комплекси). Послідовність процедури наступна. 1 етап: спочатку наносяться первинні антитіла; 2 етап: наносяться вторинні антитіла проти первинних (сполучна антитіло), при цьому один з антигензв'язуючих ділянок вторинних антитіл зв'язується з первинним антитілом, а другий залишається вільним; 3 етап: вносяться антитіла проти пероксидази або лужної фосфатази, отримані від тварини того ж виду, від якого отримані первинні антитіла, антигензв'язуючих ділянки якого зайняті відповідним ферментом. Ці антитіла зв'язуються з другим антигензв'язуючих ділянкою вторинних (сполучних) антитіл. Таким чином, формується комплекс, де з одним антигеном виявляються пов'язаними вже 2 молекули ферменту (рис.2), що збільшує чутливість методу в 2 рази.
Справжнім проривом стала розробка в 1979 році методу непрямого іммуноокрашіванія з використанням біотин-авідінового комплексу [5,6].
Таблиця 2. Ферменти, що використовуються в імуногістохімічних методиках, і відповідні їм субстрати.
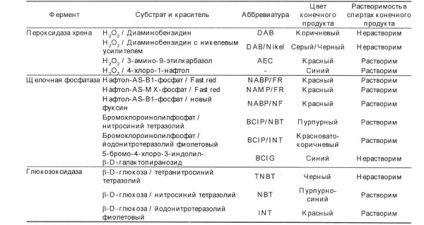
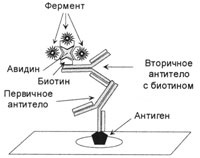
Рис 3. Кінцевий комплекс при АВС-метод
Комплекс формується в три етапи. На першому етапі немічених первинні тіла з'єднуються з антигеном, на другому етапі мічені біотином вторинні антитіла з'єднуються з первинними, на третьому додається комплекс авидин-біотин-фермент, який приєднується до біотину вторинних антитіл.
Біотин є вітаміном H, нижче приведена його хімічна формула:
Біотин - з'єднання, стійке до дії високих температур, до кислої і лужної середовищі, добре розчиняється у воді і спирті. Він є коферментом у багатьох реакціях приєднання (карбоксилювання). Біотин легко може вступати в стійке з'єднання з різними білками, в тому числі з ферментами і імуноглобулінами. У великій кількості біотин міститься в білках пташиних яєць, де він пов'язаний з гликопротеидом авидином, які мають молекулярну масу 68 кДа. Авидин утворює з біотином надзвичайно стійкий комплекс (КА = 1015моль-1). Зруйнувати такий комплекс можна тільки при температурній обробці, тому що авидин руйнується при нагріванні. Крім того, авидин має 4 місця зв'язування, до яких можна приєднати біотин або білки. Таким чином, комплекс біотин-авидин можна використовувати як сполучний місток між антитілами і ферментами. Для цього готується комплекс, що складається з ферменту, пов'язаного з біотином, і авідіна. У образующемся комплексі три центри зв'язування авідіна пов'язані через біотин з ферментом або флюорохромом, а четвертий залишається вільним (рис.3). Після інкубації з вторинними антитілами, пов'язаними з біотином, додають комплекс авидин-біотин-фермент. Таким чином, з одного молекулою антигену виявляються пов'язаними три молекули ферменту. Даний метод був названий ABC-методом (абревіатура від англійського Avidin and Biotinylated horseradish peroxidase macro-molecular Complex). На жаль, і цей метод має недоліки, так як авидин з'єднується з ендогенних біотин, який у великій кількості міститься в печінці та нирках, а також він може з'єднуватися з лектинами і зарядженими групами в тканинах, так як авидин має заряд, його ізоелектіческая точка лежить в районі pH 10,0.
Подальший розвиток отримала ця технологія після заміни авідіна на стрептавидин - білок з молекулярною масою близько 60 кДа, який отримують з мікроорганізмів Streptomyces avidinii (SaBC-метод). Стрептавідин володіє такими ж здібностями пов'язувати біотин, як і авидин, то на відміну від нього він не має заряду в нейтральному середовищі, не зв'язується з ендогенних ферментами і набагато менше з ендогенних біотин. Заміна авідіна на стрептавидин дозволила різко зменшити фонове забарвлення і підвищити чутливість методу приблизно в 8 разів.
Таблиця 3. Системи візуалізації антигенів найбільш відомих фірм