Амін Абдулфаттах Ахмад Амін
Хлорування є найбільш поширеним і фактично безальтернативним методом знезараження води в системі водопостачання Багдада. У зв'язку з цим виникає питання про регулювання змісту тригалогенметанів (ТГМ) в питній воді. Дослідженнями встановлено, що значна частина ТГМ утворюється в процесі транспортування води по водопровідних трубах, концентрація ТГМ має тенденцію до збільшення у водопровідній розподільчої мережі в міру віддалення від водоочисних станцій і має виражену взаємозв'язок з кількістю залишкового вільного хлору у воді. Показано, що найбільш раціональним способом вирішення проблеми освіти ТГМ у водопровідній мережі Багдада є використання діоксиду хлору.
Ключові слова: водопровідна мережа, діоксид хлору, знезараження, питна вода, система водопостачання, Тригалогенметани
Мал. 1. - Діапазон зміни концентрацій ТГМ4 і їх середні значення в різних точках розподільчої системи Карху (1, 2) і Расафи (3, 4) в літній (1, 3) і зимовий періоди (2, 4)
У табл. 1 і на рис. 1 наведені дані про концентрацію ТГМ в різних точках двох досліджуваних водопровідних систем. Температура водопровідної води варіювалася від 18,5 ºС в початковій точці до 22 ºС в кінцевих пунктах взимку і відповідно від 30 до 32,5 ºС влітку. З наведених даних видно, що в зимовий період значення концентрацій ТГМ4 не перевищують норматив 40 мкг / л, зазначений у II етапі Правил [10], виняток становлять найвіддаленіші точки системи Расафи, а в літній період спостерігається перевищення в усіх точках мережі. Норматив 80 мкг / л, зазначений у I етапі Правил [9], дотримувався в усі сезони року.
Таблиця № 1
Концентрація ТГМ4 (мкг / л) в різних точках розподільчої системи районів Карху і Расафи
Розподільна система Карху
На рис. 2 представлені залежності концентрації ТГМ4 і залишкового хлору від відстані між місцем взяття проби і водоочисної станцією для водопровідних систем Расафи і Аль-Карху. Відстань від водоочисної станції не пов'язане безпосередньо з часом перебування води в мережі та, відповідно, з часом контакту хлору з органічною речовиною, тому для визначення «віку» води була обрана величина залишкового хлору у водопровідній воді [11].
б)
Мал. 2. - Залежність концентрації ТГМ4 і залишкового хлору від відстані між початковою точкою розподілу води і кінцевим пунктом розподілу (влітку і взимку): а - Карх; б - Расафа
У всі сезони року спостерігається збільшення концентрації ТГМ4 зі зменшенням концентрації залишкового хлору в міру віддалення від початкової точки розподілу води і збільшенням часу контакту вільного хлору з органічною речовиною, що підкріплюється і теоретичними дослідженнями [12]. В середньому близько 30 - 38% від загального рівня ТГМ4 утворюється в процесі руху води через мережу.
У літню пору спостерігається більш високий рівень ТГМ, так як при більш високій температурі швидкість взаємодії вільного хлору з органічною речовиною зростає. Швидкість зростання концентрації ТГМ4 влітку також була вище (в 1,3-1,4 рази), ніж взимку. Суттєве значення для формування ТГМ має доза хлору, яку в теплу пору року зазвичай підвищують через підвищений ризик повторного мікробіологічного забруднення води. Дослідження показують, що кількість які виникають хлорорганічних сполук прямо пропорційно дозі введеного хлору [6, 13]. Ця тенденція спостерігається і для розглянутих водоочисних станцій Багдада: підвищення дози хлору влітку на 20% відразу відбилося на рівні ТГМ на початку мережі. Коефіцієнт кореляції між кількістю залишкового хлору і концентрацією ТГМ4 склав -0,83 ... -0,98.
На рис. 3 наведені дані про концентрацію чотирьох основних хлорорганічних сполук (CHCl3. CHCl2 Br, CHBr2 Cl, CHBr3) у водопровідній системі Карху, а на рис. 4 - середні значення концентрації основних хлорорганічних сполук для всіх досліджених ВОС. З графіків видно, що відсоток з'єднань брому (CHCl2 Br, CHBr2 Cl і CHBr3) становить близько трьох четвертих від загальної кількості хлорорганічних сполук. Швидше за все, це обумовлено наявністю бромидов в джерелах води, що сприяє підвищенню концентрації бромованих сполук ТГМ на всіх очисних станціях Багдада, і найвища вона в Карху [14].
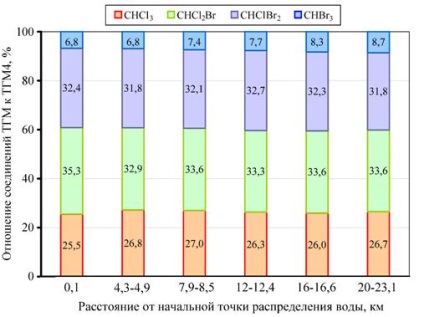
Мал. 3. - Зміна змісту основних хлорорганічних сполук в літній період в залежності від відстані між початковою точкою розподілу води і кінцевим пунктом розподілу в системі Карху
Мал. 4. - Зміна змісту основних хлорорганічних сполук на всіх досліджених ВОС в літній період
Основним джерелом утворення галогенорганических з'єднань в хлорованої питної води є містяться в ній органічні речовини. Одним з ефективних методів зниження освіти тригалогенметанів в процесі хлорування є видалення органічних компонентів з води на початковій стадії водоочищення. Однак найбільшу кількість хлорорганічних сполук утворюється у воді при первинному хлоруванні, до видалення з неї забруднень. Тому традиційні методи вирішення проблеми підвищеного вмісту ТГМ в питній воді полягають в заміні хлорування на озонування і в застосуванні сорбційної обробки води. Однак, недоліком озоно-сорбційної технології є високі витрати на її реалізацію, як капітальні, так і експлуатаційні.
В даний час розробляються нові способи дезінфекції води, засновані на поєднанні ультразвукової та кавітаційної обробки води з ультрафіолетом або озоном, застосуванні електричних розрядів і т.п. [15]. Так, китайськими вченими розроблений фотохімічний каталізатор з наночастинками паладію, який при впливі навіть звичайного світла володіє надзвичайно високим ефектом знезараження [16]. На жаль, всі ці методи не мають последействием, що накладає обмеження на область їх застосування. Рідкісним винятком тут є препарати на основі полігексаметиленгуанідину гідрохлориду - біоциди неокислювального дії, що зберігають свою ефективність протягом тривалого часу [17].
Одним з ефективних шляхів вирішення проблеми освіти ТГМ може стати застосування діоксиду хлору. Діоксид хлору (ClO2) використовується в області підготовки води для її дезінфекції при одночасному здійсненні окислювальних процесів. При розчиненні в воді діоксиду хлору утворюються хлориста (HClO2) і хлорноватої (HClO3) кислоти. Хлорати (ClO3 -) мають сильну окислювальну здатність, в кілька разів перевищує окислительную здатність хлорнуватисту кислоти (HClO) і гіпохлорит-іонів, що утворюються у воді використання рідкого хлору і гіпохлоритів натрію або кальцію.
Застосування діоксиду хлору практично повністю виключає утворення тригалогенметанів [18]. Це обумовлено тим, що при наявності діоксиду хлору в питній воді не протікають реакції хлорування. Речовини, що викликають неприємний запах і смак води, наприклад, феноли та продукти їх розпаду, окислюються діоксидом хлору і перетворюються в нейтральні за смаком і запахом речовини, що істотно підвищує якість питної води.
Швидкість знищення мікроорганізмів діоксидом хлору зростає зі збільшенням показника pH. Діоксид хлору не вступає в реакцію з амонієм і його сполуками. Це суттєва відмінність від гіпохлоритів, які утворюють з амонієм хлораміни, що роблять негативний вплив на дезінфекцію і смак оброблюваної води.
Діоксид хлору дуже стійкий у воді. Після закінчення поглинання надлишок зберігається тривалий час, що важливо в умовах великої мережі трубопроводів і резервуарів для ефективного запобігання повторного забруднення води.
У табл. 2 наведені результати порівняння обробки води річки Тигр гіпохлоритом кальцію і діоксидом хлору. Дослідження проводилися при максимальній можливій дозуванні - 0,4 мг / л, при якій діоксид хлору утворює побічні продукти окислення в безпечних кількостях [18].
Таблиця 3
Освіта тригалогенметанів при знезараженні води гіпохлоритом кальцію і діоксидом хлору
Концентрація тригалогенметанів, мг / л
З огляду на особливості фізичних і фізико-хімічних властивостей, діоксид хлору готується тільки в формі водних розчинів в місці використання з застосуванням спеціального апаратурного оформлення. Діоксид хлору проводиться з хлорита натрію (NaClO2) і хлору (Cl2) або з хлорита натрію і кислоти, переважно соляної.
Максимальний показник залишкової кількості дезінфектанту в обробленій воді становить за російськими нормативами для хлорита 0,2 мг / л [19] і 0,8 мг / л - для діоксиду хлору за нормативами США [9].