3.2.2. Застосування принципу жмко
Органічні реакції. Проілюструємо, яким чином дані табл. 3.1 можна використовувати для передбачення положення рівноваги. Метанол і метилйодид формально можна уявити як продукти нейтралізації м'якою кислоти СН3 + підставами ОН - (жорстке) і I - (м'яке). Тоді на підставі принципу ЖМКО можна "передбачити", що в реакції метанолу з иодоводорода рівновага повинна бути зрушене вправо, так як при цьому утворюються зв'язку, відповідні взаємодії "м'який-м'який" і "жорсткий-жорсткий".
І дійсно, константа рівноваги дуже велика: K »10. 9 при підтвердженні 25 о С.
В іншій наведеної нижче реакції відбувається перехід ацильного катіона (СН3 С + = О, жорстка кислота) від м'якого підстави RS - до жорсткій основі ОН -. і тому рівновага "має" бути зрушене вправо:
І дійсно, експеримент показує, що тіоефіри дуже легко реагують з водою і спиртами в слабощелочной середовищі.
Принцип ЖМКО широко застосовується в органічній хімії, і ми будемо його використовувати в наступних розділах цієї книги. Наприклад, цей принцип дуже корисний при описі шляхів реакцій амбідентних нуклеофілів, якими є енолят-іони, з електрофільними агентами (гл. 17):
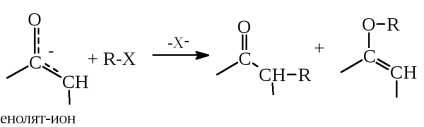
а також амбідентних електрофілов, наприклад, a, b-ненасичених карбонільних сполук, з нуклеофилами (гл. 16):
У першому випадку в енолят-йоні вуглецевий нуклеофільний центр м'якше, ніж кисневий, і тому вихід продукту алкілування по вуглецю вище, якщо "кислотна частина" електрофени R-X (тобто R +) є більш м'якою кислотою Льюїса. У другій реакції чим м'якше нуклеофил Y -. тим вище його спорідненість до більш м'якого електрофільні центру - b-вуглецевого атома, а не до жорсткішого КАРБОНІЛИ. Тому для м'яких нуклеофілів зростає роль приєднання по b-атому С = С-зв'язку (реакція Міхаеля; см. Гл. 16).
Симбіоз. На жорсткість і м'якість донорного і акцепторного атомів в підставах і кислотах відповідно впливає жорсткість або м'якість заступників, наявних в молекулі ще до утворення аддукта. Цей ефект отримав назву "симбіоз". Суть його полягає в тому, що м'які заступники роблять кислоти і підстави більш м'якими, жорсткі заступники роблять їх більш жорсткими. Наприклад, [Co (NH3) 5 F] 2+ стабільніший, ніж [Co (NH3) 5 I] 2+. оскільки жорстке підставу NH3 як би збільшує жорсткість кобальту, роблячи його більш схильним до приєднання фториду, а не йодиду. З іншого боку, якщо аміак замінити на м'який ліганд CN -. то стабільність інвертується: [Co (CN) 5 I] 3 стабільний, а [Co (CN) 5 F] 3 не існує.