Ці правила корисні в багатьох випадках. Подивіться, наприклад, як c їх допомогою легко визначається ступінь окислення елемента зі змінною (або невідомої) валентностью з молекулярної формулою. Припустимо, є з'єднання H2 SO3. Питається, як і ступінь окислення сірки? Оскільки ступінь окислення водню завжди (+1), а ступінь окислення кисню (-2), то неважко підрахувати, що позитивні і негативні ступеня окислення "урівноважать" один одного в молекулі H2 SO3 тоді, коли ступінь окислення сірки складе (+4). В цьому випадку сума алгебри всіх ступенів окислення в молекулі дорівнює нулю:
Дія цього правила можна показати і на прикладі реакції сірки з киснем, в якій електрони формально переходять від одного атома до іншого:
До реакції сірка і кисень мали однакову - нульову ступінь окислення. В результаті реакції ступінь окислення сірки підвищилася (+4). Значить, сірка окислилась.
Ступінь окислювання кисню знизилася (-2), тобто кисень відновився. Алгебраїчна сума всіх ступенів окислення в SO2 залишилася рівною нулю.
Подібних реакцій зі зміною ступенів окислення реагують атомів - сила-силенна. Всі разом вони називаються окисно-відновними реакціями.
У наступних розділах ми розглянемо ці реакції докладніше, а поки ще раз розберемося в нових термінах.
Просто так важко запам'ятати, який процес - віддачі або захоплення електронів - називається окисленням, а який - відновленням. Який атом набуває негативну, а який - позитивну ступінь окислення.
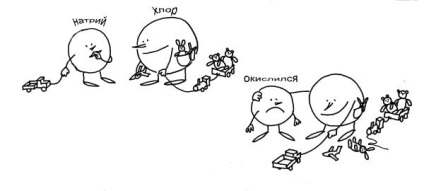
Мал. 3-11. Не зовсім звичайна запис рівняння хімічної реакції: Na + Cl = NaCl (див. Текст). Хлор - "негативний", він відбирає чужі електрони. Натрій "окислився" - це помітно по його кислому фізіономії.
Комусь із вас допоможе рис. 3-11, який розповідає про реакцію між натрієм і хлором так, як ніби це сталося в "хімічному дитячому садку". У цьому "дитячому садку" порядки такі ж, як і в звичайному. У Хлора цілих 7 іграшок (електронів). Натрію ж дістався тільки вантажівка (1 електрон). Тут Хлор побачив у Натрію вантажівка і вирішив, що саме цієї іграшки йому і не вистачає! Хлор сильніше, тому вантажівка миттєво опинився у нього. А щоб Натрій НЕ ябедничати (у нього такий окислів вид!), Хлор запропонував пограти разом. Яке там! Звичайно ж, всі 8 іграшок Хлор підтяг ближче до себе, а Натрію тільки і залишається, що стояти поруч з "окисленим" видом.
Отже, яка мораль? Хлор, звичайно, негативний. Він відібрав чужу іграшку-електрон. Тепер у нього негативна ступінь окислення. Натрій, безумовно, окислився - он який у нього "кислий" вид. Але і від Хлора не відходить - іграшок-то більше немає! Чим не картина утворення хімічного зв'язку в типовій окислювально-відновної реакції?
Залишається тільки додати, що відновлюється в таких реакціях окислювач. а окислюється - відновник. У нашій історії хлор - окислювач, а натрій - відновник.