1. Визначення. Класифікація.
2. Ізомерія і номенклатура одноосновних карбонових кислот
3. Фізичні властивості кислот
4. Хімічні властивості. Будова карбонільної групи.
Карбонові кислоти - це похідні вуглеводнів, що містять карбоксильну групу (-СООН).
Класифікація карбонових кислот
Карбонові кислоти класифікують за двома структурними ознаками.
1) За кількістю карбоксильних груп кислоти поділяються на:
Ø одноосновні (монокарбонові)
Ø багатоосновні (дикарбонові, трикарбонових і т. Д.)
2) За характером вуглеводневого радикала розрізняють кислоти:
Ø граничні (наприклад, CH3CH2CH2COOH)
Ø ненасичені (CH2 = CHCH2COOH)
Ø ароматичні (RC6H4COOH)
Одноосновні граничні карбонові кислоти
Загальна формула таких кислот - CnH2nO2 або CnH2n + 1COOH
Номенклатура і ізомерія карбонових кислот
Кислоти з числом вуглецевих атомів менше чотирьох не мають ізомерів. Якщо число атомів дорівнює чотирьом, кислоти мають два ізомери, якщо число атомів дорівнює п'яти - п'ять ізомерів.
Для назви кислот використовуються наступні типи номенклатури:
Назви карбонових кислот будуються з використанням в якості основи назви оцтової кислоти. Решта кислоти розглядаються як її похідні із заміщенням атомів водню в метильной групі на більш складні радикали. Решта правила повністю відповідають правилам раціональної номенклатури для вуглеводнів (детально вони викладені на початку лекційного курсу).
При складанні назви карбонової кислоти за основу беруть найбільш довгий ланцюг, що включає карбоксильну групу. Нумерацію починають з атома вуглецю карбоксильної групи (цифру, яка вказує на положення функціональної групи, не ставлять). До назви вуглеводню по числу атомів вуглецю в головному ланцюзі додають суфікс -овая кислота. Цифрами і приставками вказують положення і число заступників.
Номенклатура карбонових кислот ідентична номенклатурі альдегідів. що значно полегшує її розуміння і вивчення.
Назви окремих представників карбонових кислот
Отримання карбонових кислот
Багато способи отримання одноосновних кислот були розглянуті в попередніх лекціях:
1) окислення спиртів
2) озоноліз алкенов
3) окислення карбонільних сполук (альдегідів і кетонів)
4) гідроліз гемінальних трігалогенпроізводних вуглеводнів (аналогічний гідролізу дігалогенпроізводние в отриманні альдегідів, спосіб 5):
5) гідроліз похідних кислот (галогенопохідних, складних ефірів, нітрилів)
6) карбоксилирование металоорганічнихз'єднань
Це універсальний спосіб отримання карбонових кислот, є лабораторним методом.
Нижчі кислоти з числом атомів С1-С3 - безбарвні рідини, з характерним гострим запахом.
Кислоти складу С4-С9 - це маслянисті рідини з неприємним запахом, погано розчинні у воді.
Кислоти складу С10 і вище - тверді речовини не розчинні у воді.
Таким чином, зі збільшенням молекулярної маси розчинність кислот у воді зменшується.
Високі температури кипіння кислот обумовлені утворенням водневих зв'язків, з цим пов'язана і хороша розчинність в воді (відбувається утворення водневих зв'язків з молекулами води).
Міцність водневих зв'язків сприяє утворенню димарів, які стійкі навіть в газоподібному стані.
Хімічні властивості кислот
Будова карбоксильної групи
Карбоксильная група поєднує в собі дві функціональні групи - карбоніл і гідроксил, взаємно впливають один на одного:
Кислотні властивості карбонових кислот виражені досить яскраво. Це пояснюється взаємним впливом атомів в карбоксильної групі. Електронна щільність в якій зміщена на більш електронегативного кисню гідроксигрупи, що послаблює зв'язок ОН і полегшує відділення атома водню, т. Е.облегчает дисоціацію кислоти (це обумовлено тим, що + М-ефект ОН-групи переважає перед -I-ефект) . Рухливість протонів розташованих в # 945; -положенні також визначається будовою СООН-групи (докладні пояснення викладені в лекції «Альдегіди і кетони»).
1) Кислотні властивості
Дисоціація кислот. У водному розчині карбонові кислоти розпадаються на іони і мають кислою реакцією. Це можна виявити за допомогою індикатора, що вважається якісним визначенням кислот. Наприклад, лакмус набуває червоного кольору.
У водних розчинах дисоціація протікає з утворенням мезомерного аниона стабілізованого делокализацией заряду.
граничні резонансні структури зв'язку С-О вирівнюються
Мезомерія - це явище вирівнювання електронної щільності між двома атомами кисню.
Карбонові кислоти сильніші кислоти, ніж спирти.
Мурашина кислота - найсильніша, це пов'язано з відсутністю електронодонорності ефекту алкільних груп. Заступники з позитивним індуктивним ефектом (електронодонорні - СН3, С2Н5) знижують кислотність, відірвати водень від кисню в ОН-групі складніше.
Освіта солей. Кислоти здатні утворювати солі з металами, їх оксидами і гідроксидами.
а) при взаємодії з металами:
2RCOOH + Mg ® (RCOO) 2Mg + H2
б) в реакціях з гідроксидами металів:
2RCOOH + NaOH ® RCOONa + H2O
2) Реакції по ОН-групі
Освіта складних ефірів (R'-COOR ") - реакція етерифікації. Це реакція взаємодії кислот зі спиртами в присутності мінеральних кислот. Реакція оборотна.
оцтова кислота етиловий спирт етиловий ефір оцтової кислоти
Кислоти лінійної будови, типу R-CH2-COOH швидше вступають в реакцію, ніж кислоти розгалуженого будови: R2CH-COOH, R3C-COOH. Роль каталізатора в реакції етерифікації грають іони Н +:
Реакція протікає за наступним механізмом: кисень карбонільної групи захоплює протон і утворює карбкатион I. Цей карбкатион приєднує молекулу спирту за рахунок неподіленої пари атома кисню з утворенням комплексу II. Комплекс II здатний оборотним чином розпадатися і утворювати карбкатион III. при дисоціації якого утворюється складний ефір (каталізатор - протон при цьому звільняється).
Великий інтерес в цій реакції представляв питання: кислота або спирт отщепляют гідроксил в реакції ефірообразованія. За допомогою «мічених атомів» (важкого ізотопу 18О) було показано, що вода утворюється за рахунок водню спирту і гідроксилу кислоти.
(Якщо мічений кисень знаходиться в спирті, то утворюється вода містить звичайний кисень)
Реакції з повним заміщенням ОН-групи.
Отримання похідних карбонових кислот.
1) галогенангідриди кислот можна отримати дією пентахлориду фосфору (PCl5), хлористого ції (SOCl2).
2) галоген в галогенангідриди володіє великою реакційною здатністю, тому галогенангідриди використовують в якості ацілірующіх засобів. Так отримують ангідриди кислот.
Наприклад, оцтовий ангідрид (R = CH3) використовується в органічному синтезі як сильне водоотнимающее засіб.
3) освіту амідів здійснюється дією аміаку.
солі амонію амід кислоти
4) аммоноліз кислот в присутності оксиду алюмінію призводить до утворення нітрилів.
Реакції за участю атомів водню розташованих при # 945; -вуглецевого атомі.
Водневі атоми, які стоять в # 945; -положенні в граничних кислотах мають підвищену рухливістю внаслідок електронооттягівающего дії карбоксилу (див. Будова тему «Альдегіди і кетони»).
Особливими властивостями володіє мурашина кислота. оскільки вона містить альдегідну групу. Тому ця кислота має властивості відновника, наприклад, дає реакцію срібного дзеркала. А нітрит мурашиної кислоти - не що інше як ціноводородная H-CºN або синильна кислота.
Застосування окремих представників. Вплив на здоров'я людини
Мурашина кислота використовується для отримання лікарських засобів, засобів захисту рослин, консервантів, при фарбуванні тканин, має бактерицидну дію. При попаданні на шкіру викликає опіки.
Оцтова кислота застосовується у виробництві солей і ефірів (ацетатів), лікарських засобів, барвників і інсектицидів. Є консервантом. Викликає опіки.
Пропіонова кислота необхідна для синтезу гербіцидів, полімерів.
Нижчі члени ряду кислот викликають роздратування і ураження органів дихання. Монокарбонові кислоти окислюються подібно проміжних продуктів обміну речовин в організмі. Ароматичні кислоти (бензойна) виводяться з організму в незмінному вигляді.
Вищі кислоти викликають ураження печінки і зміна складу крові.
Жири - складні ефіри гліцерину і вищих одноатомних карбонових кислот.
Загальна назва таких з'єднань - тригліцериди чи тріацілгліцеріни, де ацил - залишок карбонової кислоти -C (O) R.
До складу природних тригліцеридів входять залишки насичених кислот (пальмітинової C15H31COOH, стеаринової C17H35COOH) і ненасичених (олеїнової C17H33COOH, лінолевої C17H29COOH).
Жири містяться у всіх рослинах і тваринах. Тваринні жири (баранячий, свинячий, яловичий і т. П.), Як правило, є твердими речовинами з невисокою температурою плавлення (виключення - риб'ячий жир). Жири складаються головним чином з тригліцеридів граничних кислот.
Рослинні жири - олії (соняшникова, соєва, бавовняне і ін.) - рідини (виключення - кокосова олія). До складу тригліцеридів олій входять залишки ненасичених кислот.
Рідкі жири перетворюють у тверді шляхом реакції гідрогенізації (гідрування). При цьому водень приєднується по подвійному зв'язку, що міститься в вуглеводневому радикала молекул масел.
Так отримують недороге «вершкове» масло. Таке масло дешеве, але не дуже якісне, воно швидко руйнується (прогоркает).
Продукт гідрогенізації олій - твердий жир (штучне сало, саломас). Маргарин - харчовий жир, складається із суміші гідрогенізованих масел (соняшникової, кукурудзяної, бавовни та ін.), Тваринних жирів, молока і смакових добавок (солі, цукру, вітамінів і ін.).
Жирам як складних ефірів властива оборотна реакція гідролізу, що каталізується мінеральними кислотами. При участі лугів гідроліз жирів відбувається необоротно. Продуктами в цьому випадку є мила - солі вищих карбонових кислот і лужних металів.
Натрієві солі - тверді мила, калієві - рідкі. Реакція лужного гідролізу жирів, і взагалі всіх складних ефірів, називається також омиленням.
Ненасичені кислоти: акрилова і метакрилова.
Найбільш важливими представниками ненасичених кислот є:
акрилова (пропеновая) кислота СН2 = СН-СООН
метакрилова (2-метілпропеновая) кислота
Акрилова кислота повчає синтетичним способом. Являє собою рідину з різким запахом. Легко полімеризується з утворенням полиакриловой кислоти.
Значне практичне значення мають ефіри акрилової кислоти, а точніше продукти їх полімеризації:
етиловий ефір акрилової кислоти
Поліакрилати прозорі і застосовуються для виготовлення різних пластмас і органічного скла. Більшої твердістю в порівнянні з Поліакрилати мають метакрилати - складні ефіри метакрилової кислоти.
Кращим органічним склом є плексиглас - метиловий ефір поліметакрилових кислоти. Плексиглас застосовується в медицині для виготовлення протезів.
метиловий ефір метакрилової кислоти
В цілому для ненасичених кислот характерні багато реакції, характерні для алкенів: приєднання галогенів, водню по кратному зв'язку, окислення перманганатом калію, дієновий синтез.
Двохосновні карбонові кислоти.
Найпростіша двухосновная кислота - щавлева (вперше була знайдена в щавлі) або етандіовая кислота. Наступний представник - малонова або пропандіовая кислота. Двоосновна кислота з чотирма атомами вуглецю називається бурштинової або бутандіовой.
Найважливіші реакції таких кислот - отримання конденсаційних полімерів.
Реакції етерифікації та отримання амідів дикарбонових кислот лежать в основі промислового виробництва виключно важливих в практичному відношенні конденсаційних полімерів.
Конденсація дикарбоновой кислоти і алкандиолах веде до утворення поліефіру. Поліефіри широко використовують у виробництві синтетичних волокон.
Один з найбільш важливих поліефірів - лавсан - отримують поліконденсацією терефталевой кислоти і етиленгліколю.
Конденсація дикарбоновой кислоти з діаміни веде до утворення поліаміду. Поліаміди служать для отримання синтетичних матеріалів (синтетична шерсть). Важливий в практичному відношенні поліамід - найлон-6,6 - отримують поліконденсацією адипінової кислоти і гексаметилендиамина.
У розгорнутому вигляді це виглядає наступним чином:
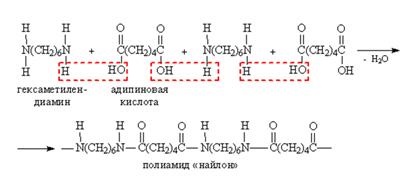
У назві «найлон-6,6» перша цифра вказує на число атомів вуглецю в дикарбоновой кислоті, а друга - число вуглецевих атомів в діаміни.
Якщо процесу поліконденсації піддають суміш ароматичної дикарбоновой кислоти (наприклад, терефталевої кислоти) і ароматичного диамина, то отримують поліамідні матеріали, які можна порівняти за міцністю з виробами із сталі: