Каталітичних процесів У хлорорганічних синтезу (II частина)
Процеси окисного хлорування
Розглянуто каталітичні процеси окисного хлорування граничних і ненасичених вуглеводнів С1-С3, що є основним напрямком утилізації хлористого водню і визначають збалансованість по хлору. Проаналізовано кінетичні та технологічні закономірності процесів отримання хлорметанов, дихлоретан і вінілхлориду, аллілхлоріда. Розглянуто шляхи кваліфікованої переробки хлорорганічних відходів методом гідрування і оксіхлорірованія, що забезпечують повне використання вуглеводневої сировини.

Схема I. Сполучення реакції окислення хлористого водню
з реакцією замісного хлорування граничних вуглеводнів:
Схема II. Сполучення реакцій (1) і (2) схеми I з реакцією дегідрохлорування граничних хлорпроізводних вуглеводнів.
Схема III. Реакція присоединительного оксіхлорірованія ненасичених вуглеводнів.
Схема IV. Реакція замісного оксіхлорірованія ненасичених вуглеводнів.
З огляду на також побічні реакції глибокого окислення до моно- і діоксиду вуглецю, можна зробити висновок про те, що оксіхлорірованіе вуглеводнів є складним, багатомаршрутному процесом, умови якого повинні підбиратися в залежності від поставленого завдання.
Основою для процесу оксіхлорірованія послужила газофазних реакція окислення хлористого водню, відкрита Диконом в 1868р.
Окислення хлористого водню до хлору - оборотна реакція, що протікає зазвичай при температурі близько 400 0 С. Залежність константи рівноваги від температури має вигляд [4]:
Величини Kp і ступеня конверсії HCl і O2 помітно знижуються з підвищенням температури процесу. Збільшення надлишку кисню і підвищення тиску призводить до збільшення ступеня конверсії HCl і змісту Cl2 в реакційній суміші, але в інтервалі температур 600-700К, коли швидкість процесу досить висока, рівноважна конверсія HCl не досягає 90%.
При спільному протіканні реакцій Дикона (1) і хлорування (2), (2 1) рівновага реакції зміщується за рахунок витрачання хлору, внаслідок чого може мати місце практично повне перетворення HCl. З цієї причини все реакції оксіхлорірованія алканів, алкенів, а також їх хлорпроізводних практично незворотні в робочому інтервалі температур [5].
Загальноприйнятою є точка зору, згідно з якою в умовах окислення HCl і високотемпературного оксіхлорірованія каталитически активні компоненти, як правило, суміші хлоридів міді, лужних і рідкоземельних елементів, знаходяться на поверхні носія в стані розплаву. Поява в процесі хлоридів одновалентних міді, як і введення в систему хлоридів лужних металів, призводить до зниження температур плавлення евтектики в використовуваних каталізаторах.
На основі результатів кінетичних і адсорбційних досліджень була запропонована загальна схема реакції Дикона в присутності хлормедних каталізаторів [3, 6, 7]:
Цією схемою відповідає наступне кінетичне рівняння:
де К - константа рівноваги термічної дисоціації хлориду міді;
k - константа швидкості адсорбції кисню.
Отримані дані були використані при дослідженні закономірностей окисного хлорування граничних вуглеводнів - метану і етану.
Окислення HCl в присутності метану протікає по кінетичним закономірностям, встановленим для процесу Дикона, тобто незалежно від наявності в реакційній суміші хлорметанов. Інший виявленої особливістю стала спільність кінетичних закономірностей утворення хлорметанов в реакціях оксіхлорірованія і прямого хлорування в присутності системи CuCl2 -KCl. Обидві реакції характеризуються першим кінетичним порядком за метаном, дробовим по хлору і практично однаковими значеннями енергії активації (113 кДж / моль). Швидкості оксіхлорірованія і хлорування можуть бути описані рівнянням статечного вигляду, де порядок по кисню змінюється від 0 до 0,25 [3, 8, 9].
Окислення HCl йде у всьому обсязі розплаву на каталізаторі, в той час як реакції хлорування метану і хлорметанов, а також їх окислення - на поверхні розплаву. Крім того, ці реакції протікають на різних активних центрах, причому присутність катіона перехідних металів в центрах, на яких йде хлорування, не обов'язково. Реакція хлорування метану до 425 0 С протікає переважно по гетерогенному механізму, а при більш високих температурах превалюючим може бути гетерогенно-гомогенний механізм з квадратичним обривом ланцюга по хлору.
Технологічне оформлення процесу оксіхлорірованія метану може бути різним, з використанням псевдоожиженного або нерухомого шару каталізатора. Можлива комбінація обох варіантів, що забезпечує ефективне знімання і високу ступінь перетворення вихідних реагентів.
Певні перспективи представляють можливість промислової реалізації процесу оксіхлорірованія етану з безпосереднім отриманням цільового продукту - вінілхлориду. Пік дослідних робіт в цьому напрямку припав на 70-ті - 80-ті роки ХХ століття і був пов'язаний з істотною дешевизною природного газу в порівнянні з аномально високими цінами нафтової сировини в цей період.
Як з наукової, так і з прикладної точок зору інтерес представляє гетерогеннокаталітіческій, газофазний процес оксіхлорірованія етану. Процес протікає в присутності традиційних каталізаторів Дикона - хлориду міді з добавками на інертному носії. Залежно від умов проведення процесу можливе утворення широкої гами хлорпроізводних етану і етилену. Для переважного освіти вінілхлориду кращі високі температури 400-550 0 С.
Як і при оксіхлорірованіі метану, процеси утворення хлору і подальшого хлорування протікають на різних активних центрах. Оксіхлорірованіе етану і хлорпроізводних етан-ряду етилену являє собою складний гетерогенно-гомогенний процес, що протікає через ряд паралельно-послідовних стадій хлорування, дегідрохлорування, дехлорування і супроводжується реакціями глибокого окислення вихідних речовин і напівпродуктів. Загальна схема перетворень етану виглядає наступним чином [10]:
гомогенно гомогенно гетерогенно гетерогенно
гомогенно ↓ ↑ гомогенно
При проведенні процесу при температурі 500-550 0 С основними продуктами є вінілхлорид і етилен, сумарний вихід яких досягає 80% [11]. Швидкість убутку етану не залежить від парціального тиску HCl і добре описується наступним рівнянням [12]:
Аналогічним закономірностям підкоряється і швидкість убутку хлорпроізводних метану за винятком 1,1-дихлоретану.
В ході процесу оксіхлорірованія етану протікають також побічні реакції окислення вуглеводнів і їх хлорзамещенних з утворенням оксидів вуглецю. Швидкість реакцій окиснення описується рівнянням:
Основний внесок в швидкість утворення продуктів глибокого окислення вносять ненасичені сполуки [13]; при цьому введення одного атома хлору в молекулу різко (в 7-8 разів) збільшує швидкість окислення. Подальше збільшення кількості атомів хлору зменшує вихід продуктів сіх: три- і тетрахлоретени в умовах процесу практично не окислюються. Найкращі технологічні показники процесу досягнуті при використанні каталізаторів CuCl2 -KCl / носій, питома поверхня яких не повинна перевищувати 10 м 2 / г. Вибірковість процесу по вінілхлориду становить 35-40% при ступені перетворення етану
95% [14]. При таких значеннях конверсії реагентів і в присутності водяної пари (один з продуктів процесу) відбувається вторинні перетворення: відновлення вінілхлориду до етилену, а ацетилену до оксиду вуглецю.
Незважаючи на глибоку наукову і технологічну опрацювання, процеси оксіхлорірованія метану і етану в промислових умовах поки не реалізовані.
Причиною цього є високі капітальні вкладення в поєднанні зі зменшеним попитом на хлорметан (випуск чотирихлористого вуглецю взагалі заборонений Монреальським протоколом 1987р.). Пряма переробка етану в вінілхлорид супроводжується утворенням бóльшего кількості відходів в порівнянні з «етиленовим» процесом. Певну роль відіграє також бóБільша доступність сировини для отримання етилену (бензин, дизельне паливо) стосовно до європейських країн.
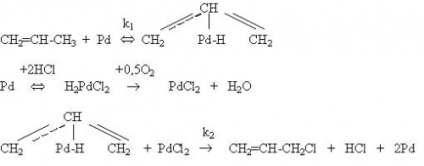
З процесів окисного хлорування найбільше практичне значення має окислительное хлорування етилену з одержанням 1,2-дихлоретан як ключова стадія збалансованої схеми виробництва вінілхлориду. Окислювальне хлорування етилену протікає на каталізаторах, що містять CuCl2. при значно нижчих (200-3000С) температурах, ніж процеси Дикона або оксіхлорірованіе граничних вуглеводнів, і не включає стадію окислення HCl. Механізм оксіхлорірованія включає стадію взаємодії етилену з CuCl2. в результаті якого утворюється відновлена форма міді:
Cl Cl Cl Cl Cl ClC2 H4 Cl Cl / / / / Cu Cu Cu Cu (1a) (1 в) - Al - O - Al - O - Al - + C2 H4 ® - Al - O - Al - O - Al - ® | | | | | | Cl Cl | | Cu Cu (1с) ® - Al - O - Al - O - Al - + C2 H4 Cl2 (1) | | | Cl Cl Cl O Cl | | / / (I) Cu Cu Cu Cu (1с) (2а) - Al - O - Al - O - Al - + ½ O2 ® - Al - O - Al - O - Al - (2) | | | | | | Cl O Cl Cl Cl Cl Cl / / / / Cu Cu Cu Cu (2а) (1а) - Al - O - Al - O - Al - + 2HCl ® - Al - O - Al - O - Al - + H2 O ( 3) | | | | | |
Поряд з хлоридом міді в каталізатори оксіхлорірованія етилену можуть вводитися в якості промоторів або стабілізаторів хлориди таких металів як лантан, магній, калій і ін. Які, з одного боку, збільшують здатність катіонів міді до координаційної зв'язування з олефінами, з іншого боку, сприяють зменшенню частки побічних реакцій, зокрема, реакцій глибокого окислення [15, c.79].
Побічні продукти в процесі оксіхлорірованія етилену можуть бути умовно розділені на дві групи:
1. Побічні хлорорганічні продукти, які включають в себе більшу частину хлорзамещенних вуглеводнів С1-С2 як парафинового, так і олефінового ряду;
2. Продукти глибокого окислення - СО і СО2.
З огляду на те, що на частку оксидів вуглецю припадає до 70% етилену, що перетворюється в побічні продукти, дослідження умов їх утворення є важливою прикладною задачею. Показано [23], що швидкість утворення продуктів сіх описується рівнянням типу:
де i - етилен або дихлоретан, причому швидкість окислення дихлоретан приблизно вдвічі вище швидкості окислення етилену.
Окислення етилену і дихлоретану протікає, в основному, на активних центрах, що містять фази CuCl2 і Cu2 (OH) 3 Cl, надлишкових щодо взаємодії з носієм [24,25]. Беручи активні форми міді в якості активних центрів реакцій глибокого окислення, можна вважати, що в схемі (I) реокісленная форма міді по реакції (2), координаційно пов'язана з носієм, окисляє органічний субстрат. Реакція окислення конкурує з реакцією (1) наведеної схеми, що пояснює гальмує роль HCl в реакціях окислення.
Загальна схема освіти оксидів вуглецю в процесі виглядає наступним чином
[23]: C 2 H 4 → CH 2 ClCH 2 Cl → CH 2 ClCHO → CCl 3 CHO I II III СО ↓ CO 2
Співвідношення швидкостей маршрутів освіти продуктів сіх r1. r2. r3 = 1: 2: 0,3
Дані, отримані при дослідженні структури каталізаторів і її впливу на кінетичні та технологічні параметри, були використані при розробці промислового процесу оксіхлорірованія етилену.
Всі процеси оксіхлорірованія етилену можуть бути розділені за двома основними ознаками: використання кисню повітря або чистого кисню і застосування киплячого або нерухомого шару каталізатора. У таблиці 1 наведені характеристики найбільш важливих промислових процесів оксіхлорірованія.
Таблиця 1. Характеристики промислових процесів оксіхлорірованія.
Швидкість освіти аллілхлоріда можна представити рівнянням:
Каталізатори також грають важливу роль в реалізації принципу збалансованості процесів щодо вуглеводневої сировини. Найбільш перспективним є створення промислових процесів оксіхлорірованія хлоруглеводородов С2 - С3 з отриманням три- і перхлоретілена, а також їх селективного гідрування з отриманням відповідно етилену і пропилену і поверненням їх в технологічний цикл.
Оксіхлорірованіе хлорпроізводних С2 - С3 проводять в присутності суміші хлоридів міді і калію, нанесених на пористий носій. Переважно використання носіїв з низькою питомою поверхнею (10-15 м2 / г) з метою зниження утворення побічних продуктів глибокого окислення [30,31]. Встановлено, що при температурах, що перевищують 350 0С, на медьсодержащих носіях протікає реакція окислення хлористого водню до хлору і участь останнього в подальших перетвореннях. Швидкість оксіхлорірованія 1,2-дихлоретан описується рівнянням (аналогічним прийнятому для оксіхлорірованія алкенов [32]):
:
Тим самим досягається збалансованість процесів щодо вуглеводневої сировини.
Метод гідрування може бути також використаний при переробці чотирихлористого вуглецю, випуск якого заборонений Монреальським протоколом 1987р. в хлороформ: CCl 4 + Н 2 ® CHCl 3 + HCl
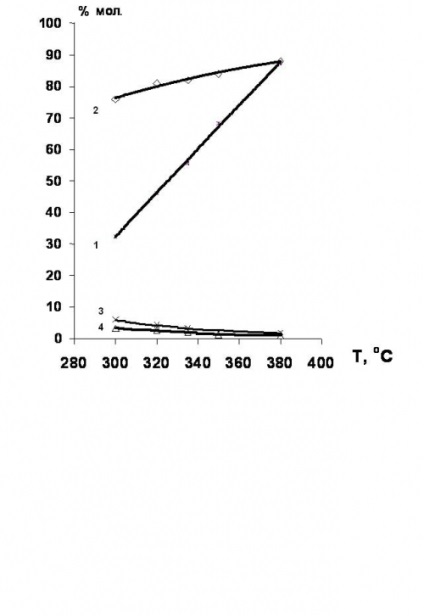
Встановлено [34,35], що гідродехлорірованіе хлорпроізводних етан-ряду етилену доцільно проводити в присутності никельсодержащих каталізаторів. Вихід етилену в цьому випадку досягає 80% (рис.4).
Паладієві каталізатори активніші, але менш селективні в порівнянні з нікелевими: основним продуктом в цьому випадку є етан, вихід якого досягає 70%, а вихід етилену не перевищує 10-15%.
Як нами показано [34], гідродехлорірованіе йде переважно за механізмом, який передбачає Мультиплетність відрив атомів хлору від молекули вихідної сполуки. Швидкість реакції гідродехлорірованія виражається наступним рівнянням:
Реакційна здатність хлоролефінов при цьому нижче в порівнянні з хлоралканамі [35].
У промислових умовах процес слід проводити в стаціонарному шарі каталізатора з використанням трубчастого реактора. Температура 320-370 0С, час контакту 5-10 с, мольної співвідношення водню на один атом хлору дорівнює 0,5: 1.
Каталізатор, розроблений для даного процесу, відрізняється високою стабільністю.
Для переробки вторинних відходів, таких як гексахлорбензол, гексахлоретан і ін. Доцільно використовувати паладієві каталізатори. Обесхлоренние органічні продукти направляються далі на спалювання, а хлористий водень може бути утилізований в технологічному процесі.
Висновок.
Промислове значення процесів хлорорганічних синтезу в перспективі буде зростати. Це пов'язано з необхідністю все більш широкого, комплексного використання мінеральної та органічної сировини, до яких, в даному випадку, відносяться кухонна сіль і продукти вторинної переробки нафти і природного газу. Необхідною умовою цього є мінімальний вплив на навколишнє середовище. Реалізація цього принципу повинна здійснюватися, по крайней мере, в двох напрямках:
1. Створення процесів, повністю збалансованих по хлору і вуглеводневої сировини;
2. Наявність кваліфікованої, екологічно безпечної технології переробки відходів виробництва і споживання хлорорганічних продуктів.
Рис.1. Залежність lg константи швидкості реакції від величини # 61508; Н зв'язку M-Cl.
_____ експериментальні дані
------- розрахункові дані
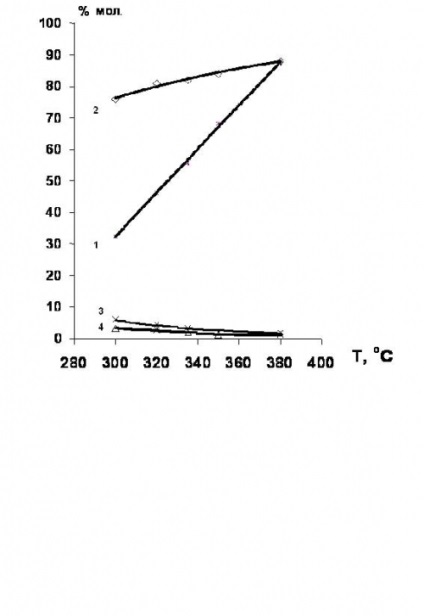
Рис.2. Технологічна схема процесу оксіхлорірованія етилену в псевдозрідженому шарі каталізатора
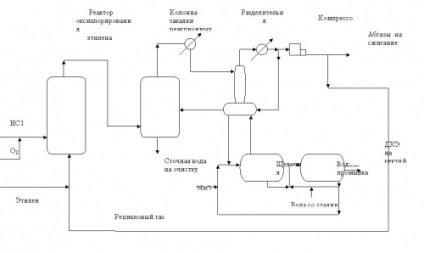
Рис.3. Технологічна схема процесу оксіхлорірованія етилену в нерухомому шарі каталізатора.
Рис.4. Температурні залежності конверсії 1,2-дихлоретану і селективності утворення продуктів гідрохлорування в присутності Ni-вмісних каталізаторів.
1 - конверсія 1,2-дихлоретан;
селективності освіти: 2 - етилену; 3 - етану; 4 Етілхлорід