Ви вже знаєте чимало визначень кислот як класу складних речовин.
Кислотами називають складні речовини, які складаються з атомів водню, здатних заміщатися на метал, і кислотного залишку.
У світлі теорії електролітичної дисоціації до кислотам відносять електроліти, які при дисоціації утворюють катіони тільки одного типу - гідратованих іони водню.
Теорія електролітичноїдисоціації пояснює кислотно-основні властивості водних розчинів електролітів присутністю в них надлишку іонів.
Поряд з цим відомі реакції, в яких речовини взаємодіють як кислота і підставу при відсутності в них іонів водню і гідроксид-іонів. Згадайте, наприклад, освіту хлориду амонію при взаємодії газоподібних хлороводню і аміаку. відоме вам як дим без вогню.
У 1923 р з'явилася Протолітична теорія кислот і підстав Бренстеда-Лаур і, яка розширила уявлення про кислотах і підставах, пояснила поведінку речовин у водних і неводних (спиртових, ефірних, аміачна) розчинах. Відповідно до цієї теорії кислоти - це молекули або іони, які є в даній реакції донорами катіонів водню Н + тобто віддають їх.
Відповідно снования - це молекули або іони, які прий мают катіони Н +, тобто є акцепторами Н +.
З точки зору цієї теорії розпад електроліту на іони (I) і гідроліз за аніоном (2) розглядають як кислотно-основна взаємодія електролітів і води.
В реакції (1) Н20 поводиться як підстава - приєднує протон (Н +) і утворює іон оксония по донорно-акцепторного механізму.
Тепер, коли ви познайомилися з більш широким поглядом на ірнроду кислотно-основних властивостей хімічних сполук, зробимо узагальнення відомостей про клас кислот, розглянувши класифікацію і властивості неорганічних і органічних кислот (табл. 17).
властивості кислот
Кислий смак, дія на індикатори, електрична провідність, взаємодія з металами, основними і амфотерними оксидами, основами і солями, утворення складних ефірів зі спиртами - ці властивості є загальними для неорганічних і органічних кислот.
1. У воді кислоти дисоціюють на катіони водню і аніони кислотних залишків, наприклад:

Розчини кислот змінюють колір індикаторів: лакмус - в червоний, метилового оранжевого - в рожевий колір фенолфталеїну не змінюють.
2. Розчини кислот реагують з металами. що стоять в електрохімічному ряді напруг лівіше водню, при дотриманні ряду умов, найважливішим з яких є утворення в результаті реакції розчинної солі.
3. Неорганічні та органічні кислоти взаємодіють з основними і амфотерними оксидами за умови, що утворюється розчинні солі.
4. І ті й інші кислоти вступають в реакцію з підставами. Багатоосновні кислоти можуть утворити як середні, так і кислі солі (це реакції нейтралізації)
5. Реакція між кислотами і солями йде тільки в тому випадку, якщо утворюється осад або газ.
6. Складні ефіри утворюють не тільки органічні кислоти відповідно до загального рівняння.
Аналогічна реакція з ушетіем двох і трьох гідроксо-груп целюлози при її нитровании призводить до отримання складних зфіров: ли і тринитроцеллюлоза - дуже необхідних речовин для виробництва бездимного пороху.
Разом з тим окремі представники мінеральних і органічних кислот мають і особливі властивості.
Оцтова кислота СН3СО0Н, як і інші карбонові кислоти, містить в молекулі вуглеводневий радикал. У ньому можливі реакції заміщення водню галогенами:
Під впливом атомів галогену в молекулі кислоти її ступінь дисоціації сильно підвищується. Наприклад, хлоруксус-ня кислота майже в 100 разів сильніше оцтової (чому?).
Мурашина кислота НСООН. в отлмчіе від оцтової, не має в молекулі вуглеводневої радикала. Замість нього вона містить атом водню, а тому є речовиною з двоїстої функцією - альдегідокіслот і. на відміну від інших карбонових кислот, дає реакцію «срібного дзеркала». Утвориться вугільна кислота Н2С03 розпадається на воду і вуглекислий газ.
1. Як природа кислоти впливає на ступінь електролітіческойдіссоціаціі? Розгляньте це вплив на прикладах: а) азотної і азотистої кислот, б) хлорнуватисту НСlO і хлорного НСl04. d) сірчистої та сірчаної кислот. Зробіть загальний висновок.
2. Розгляньте взаємний вплив атомів в молекулі Пропп-Пнів кислоти СН3-СН2-СООН за планом: а) вплив радикала на карбоксил; б) вплив карбоксилу на радикал; в) вплив карбоннла на гідрокенл; г) вплив гідроксилу на карбонил.
3. Розмістіть хлорпронзводние оцтової кислоти в порядку збільшення їх сили. Поясніть відповідь.
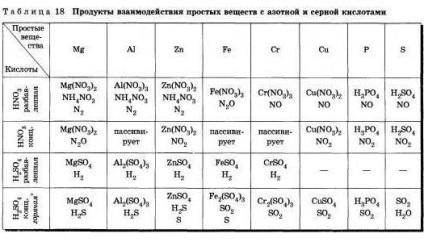
4. пошани азотна і сірчана (конц.) Кислоти поводяться в реакціях з металами інакше, ніж, наприклад, соляна?
8. У 730 г 12% -ної соляної кислоти розчинили 33.б л хлороводню. Знайдіть масову частку хлороподорода в отриманому розчині.
Відповідь: 18.14%.
9. У 820 г 0.5% -ного розчину сірчистої кислоти розчинили ще 11.2л сірчистого газу. Який стала масова частка кислоти в отриманому розчині?
Відповідь: 5.29%.
Якщо у вас є виправлення або пропозиції до даного уроку, напишіть нам.
Якщо ви хочете побачити інші коригування та побажання до уроків, дивіться тут - Освітній форум.