Кристалізацію слід розглядати як двохстадійний процес. На першому етапі відбувається формування, так званих, кластерів, в прикордонному кристалізаційна шарі, на другому - їх приєднання до фронту кристалізації. При цій моделі вплив специфічних особливостей атомів домішки, присутніх в розплаві заліза, має проявлятися двічі:
- при формуванні поверхонь кластерів, які можуть володіти різним ступенем атомної шорсткості, в результаті чого виникає різне число дефектів типу вакансій;
- при приєднанні кластерів з різною якістю поверхні і числом дефектів до твердої поверхні, тобто відмінність будови поверхні кластера буде істотно впливати на ймовірність його приєднання, а також на частоту виникнення дефектів типу дислокацій.
В якості запобіжного обурює впливу домішки на затвердіння може бути використана абсолютна величина різниці коефіцієнтів акомодації заліза і домішки (рис. 1).
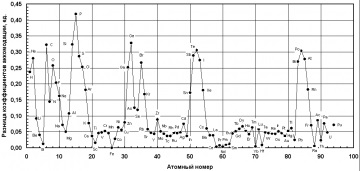
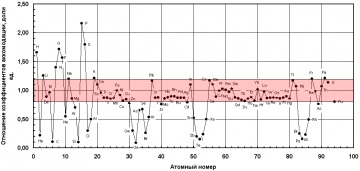
Як видно, найбільше утрудняє дію на процес кристалізації заліза (і сплавів на його основі) можуть надавати такі елементи: P. S. O. H, F, Ge, Si. C. Te, Po, Sb.
Фізична сутність коефіцієнта акомодації розкрита нижче.
Елементарний процес плавлення або затвердіння відбувається тоді, коли атом (або кластер) на поверхні задовольняє одночасно трьом вимогам:
1. володіє енергією, достатньою, щоб перейти в активований стан;
2. має згідно велику складову швидкості по нормалі до поверхні розділу;
3. має в іншій фазі позицію, в якій зможе закріпитися.
Розглянемо тепер ці три вимоги.
1. Нехай енергія зв'язку на атом в твердому тілі дорівнює ES (S - від англ. "Solid"), в рідкому тілі EL (L - від англ. "Liquid"), а енергію активованого стану, т. Е. Мінімальну енергію, необхідну для переходу з твердої фази в рідку, позначимо через EA.
Якщо частоту коливань атомів у твердій фазі позначити через vS. а в рідини - через vL. і якщо енергію будь-якого подальшого коливання вважати незалежною від енергії попереднього, то щосекунди атом набуває необхідну для плавлення енергію vS · ехр [-QS-L / (R · T)] раз; в разі затвердіння це число дорівнює vL · ехр [-QS-L / (R · T)].
2. Визначимо геометричні фактори GL і GS як частки атомів, енергія яких така, що складова їх швидкості по нормалі до поверхні розділу досить велика, щоб вони покинули дану фазу.
3. Якщо атом володіє достатньою енергією і рухається в потрібному напрямку, то він може знайти належну позицію на поверхні іншої фази. Це повинна бути геометрично відповідна позиція, а атом повинен негайно передати частину своєї енергії новим сусідам за допомогою непружного зіткнення. Якщо цього не станеться, то атом знову перейде в активований стан і повернеться в колишню фазу. Імовірність того, що атом перейде в іншу фазу, називається коефіцієнтом аккомодацііAL-S (ймовірність переходу з рідкої фазив тверду) іліAS-L (ймовірність переходу з твердої фази в рідку).
Тоді, щомиті все три умови задовольняються
Якщо на одиничну площу поверхні доводиться з боку твердої і рідкої фаз відповідно NS і NL атомів, то швидкості плавлення і затвердіння (що виражаються числом атомів, щомиті перетинають одиничну площадку) складають
Ці два процеси (плавлення і затвердіння) вважаються відбуваються одночасно і незалежно. Зрозуміло, що якщо фактична температура розплаву вище температури плавлення / кристалізації, то переважає плавлення, якщо ж вона не досягає рівноважної, то превалює затвердіння. У разі, коли температура дорівнює TL-S. швидкості цих двох процесів рівні між собою.
Характерно, що деякі з параметрів цього рівняння залежать від природи речовини і що, крім того, NS і AL-S залежать ще від кристалографічної орієнтації поверхні розділу. З цього випливає, що хоча величина TS-L для всіх поверхневих орієнтацій даної речовини, ймовірно, однакова, значення R 'для заданого відхилення від рівноваги має бути, без сумніву, різним.
Як вже було сказано, при рівноважної температурі TS-L ці дві швидкості рівні, тобто
Звідки з урахуванням (1)
Таким чином, рівноважна температура плавлення / кріталлізаціі повинна бути пропорційна прихованої теплоті плавлення і залежати ще від величини відносини двох коефіцієнтів акомодації. Можливо, що коефіцієнт AS-L дорівнює або близький до одиниці і що він однаковий для розплавів всіх металів і, можливо, навіть для всіх рідин. тоді наближено
З огляду на експериментальні результати Оррока і Чалмерса для різних кристалічних структур, переконливо демонструють залежність теплоти кристалізації від температури плавлення, можна припустити, що величина AL-S є функцією цих взаємопов'язаних величин і також залежить від кристалічної структури твердої фази і від кристаллографического характеру поверхні.
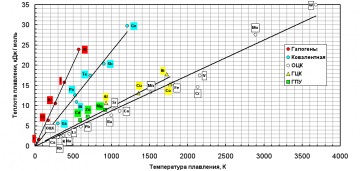
Таким чином, коефіцієнт акомодації є функцією теплоти і температури плавлення. Крім того, він практично функціонально залежить від різниці індивідуальних фізичних характеристик елемента (величини заряду ядра, радіуса атома, взаємодії між електронами в електричному полі ядра), сумарно описуваних величиною потенціалу іонізації.