Колоїдні системи за ступенем дисперсності займають проміжне положення між грубодисперсними системами і істинними розчинами. Тому їх можна отримувати двома шляхами:
а) методами диспергування - дробленням більш великих часток до колоїдної ступеня дисперсності - механічним, електричним, ультразвуком, пептизацією (перетворення опадів у колоїдний розчин під впливом хімічних речовин - пептизаторів);
б) методами конденсації - укрупненням частинок в агрегати колоїдної ступеня дисперсності (отримання нерозчинних речовин в результаті реакцій різних типів);
в) ультрафильтрацией через напівпроникні мембрани.
Будова колоїдних частинок
Освіта нерозчинної речовини в результаті хімічної реакції - це лише одна з умов отримання колоїдного розчину. Іншим не менш важливою умовою є нерівність вихідних речовин, узятих в реакцію. Наслідком цієї нерівності є обмеження зростання величини частинок колоїдах розчинів, яке при-вело б до утворення грубодисперсной системи.
Механізм утворення колоїдної частинки розглянемо на примі-ре освіти золю йодистого срібла, який виходить при взаємо-модействие розбавлених розчинів азотнокислого срібла і йодисто-го калію.
Нерозчинні нейтральні молекули йодистого срібла утворюють ядро колоїдної частинки.
Спочатку ці молекули з'єднуються в безладді, утворюючи аморфну, пухку структуру, яка поступово перетворюється в високоупо-рядоченную кристалічну структуру ядра. У розглянутому нами прикладі ядро це кристалик йодистого срібла, що складається з біль-шого числа (m) молекул AgI:
m [Agl] - ядро колоїдної частинки
На поверхні ядра відбувається адсорбційний процес. За правилом Пєскова-Фаянсу, на поверхні ядер колоїдних частинок адсорбуються іони, що входять до складу ядра частинки, тобто адсорбуються іони срібла (Аg +) або іони йоду (I -). З цих двох видів іонів адсорбіруютcя ті, які знаходяться в надлишку.
Так, якщо отримувати колоїдний розчин в надлишку йодистого калію, то адсорбироваться на частинках (ядрах) будуть іони йоду, які добудовують кристалічну ре-щітка ядра, природно і міцно входячи в його структуру. При цьому утворюється адсорбційний шар, який надає ядру негативний заряд:
Іони, адсорбуватися на поверхні отрута-ра, надаючи йому відповідний заряд, називаються потенціалобразующімі іонами.
При цьому в розчині знаходяться і протилежно заряджені іони, їх називають противоионами. У нашому випадку це іони калію (K +), які електростатично притягуються до зарядженого ядра (величи-на заряду може досягати I в). Частина протиіонів До + міцно зв'язок-ється електричними і адсорбційними силам і і входить в адсорбційний шар. Ядро з утворився на ньому подвійним адсорбційним шаром іонів називається гранулою.
Частина, що залишилася противоионов (позначимо їх числом "х К +") утворює дифузний шар іонів.
Ядро з адсорбційним і дифузним шарами називається міцели:
При пропущенні постійного електричного струму через колоїдний розчин гранули і протівоіони рушать до протилежно зоря-женним електродів відповідно.
Наявність однойменного заряду на поверхні частинок золів являє-ся важливим фактором його стійкості. Заряд перешкоджає злипанню і укрупнення частинок. В стійкої дисперсної системі частки утримуються в підвішеному стані, тобто не відбувається випадання в осад колоїдного речовини. Це властивість золів називається кине-чеський стійкістю.
Будова мицелл золю йодистого срібла, отриманого в надлишку AgNO3. представлено на рис. 1а, в надлишку KCI - 1б.
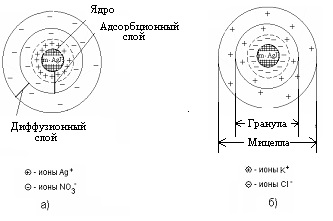
Рис.1.5. Будова мицелл золю іодістоого срібла, отриманого в надлишку:
а) азотнокислого срібла; б) хлориду калію.