Серед біологічно активних речовин, що містяться в організмі, іони металів займають особливе місце. Так, біокатіони є найбільш чутливими "хімічними точками" організму. Ці біогенні елементи життя знаходяться в організмі, головним чином, у вигляді водних розчинів їх солей і комплексних (координаційних) сполук.
Комплексними сполуками називаються сполуки, в вузлах кристалічної решітки яких знаходяться складні частки (комплексні іони), що складаються з центрального атома або іона і оточуючих його нейтральних молекул або іонів. Комплексні іони не руйнуються при переході їх в розчин або розплав.
Будова комплексних сполук отримало пояснення в координаційної теорії А. Вернера (1893р). За координаційної теорії Вернера комплексні сполуки характеризуються особливим просторовим розташуванням частинок, складових їх молекули. Наприклад: K + | CN - CN - | K +
З наведеної координаційної формули видно, що один з іонів займає центральне положення. Такий атом або іон називається комплексоутворювачем. Найчастіше комплексоутворювачами є позитивно заряджені іони металів, частіше метали побічних підгруп (d- і f-елементів), значно рідше - нейтральні атоми металів (Fe, Ni) і негативно заряджені атоми неметалів (N -3. O -2. S). Типовими комплексоутворювачами є такі метали, як Fe, Cu, Ag, Au, Hg, Co, Cr, Mn, Cd, Ni, Pt, і ін. D- і f-елементи. Поблизу комплексообразователя в певному порядку розташовані полярні молекули або іони іншого знака, іноді ті й інші, їх називають лігандами (аддендов), що означає "пов'язані". Найважливішими лигандами є:
a) Нейтральні молекули, що мають дипольний характер: H2 O, NH3. CO, NO, C2 H4.
б) Іони: H -. O -2. OH -. Cl -. J -. Br -. CN -. HCO3 -. а також біолігандами у вигляді макромолекул амінокислот і їх похідних, пептидів, білків, ферментів, гормонів, нуклеїнових кислот і їх фрагментів.
Комплексоутворювач і ліганди утворюють внутрішню сферу (позначається квадратними дужками), а іони, які не увійшли у внутрішню сфери, утворюють зовнішню сферу. Внутрішню сферу часто укладають у квадратні дужки. Заряд комплексного іона дорівнює алгебраїчній сумі зарядів комплексоутворювача і лігандів. Число лігандів, розташованих в безпосередній близькості від центрального іона, називаютсякоордінаціонним числом іона (к.ч.). Часто зустрічаються координаційні числа 2, 4, 6. Зазвичай координаційне число в два рази більше заряду комплексоутворювача, винятком є іон Fe 2+. для якого к.ч. дорівнює 6, для Pt 4+ - 6.
Якщо ліганди пов'язані з комплексоутворювачем одним зв'язком і займають одне координаційне місце у внутрішній сфері комплексу, такі ліганди називаються монодентантнимі (OH -. Cl -. J -. Br -. CN), дві -бідентантнимі (CO3 2-. С2 О4 2) - вони займають 2 координаційних місця. Деякі ліганди приєднуються до центрального іону та великим числом координаційних зв'язків. Так, серед складних органічних сполук є такі, які можуть виступати в ролі три, тетра - і більше - їх називають полідентантнимі. Полідентантние органічні ліганди, замикаючись двома або кількома координаційними зв'язками, можуть утворювати циклічні комплекси.
Молекули комплексних сполук відрізняються цілком певної геометричною структурою. Так, два ліганда часто розташовуються близько іона металу таким чином, що центральний іон і 2 лиганда виявляються на одній прямій. Три лиганда розміщуються по кутах трикутника, чотири - по кутах квадрата або четирехгранніка (тетраедра), шість - по кутках восьмигранника (октаедра), вісім - по кутах куба. Якщо ліганди неоднакові, то геометричні форми можуть бути і не зовсім правильними (перекрученими), але, тим не менш, ліганди залишаються фіксованими в певних точках простору навколо центрального іона.
Комплексні сполуки класифікують по заряду комплексного іона і по типу лігандів. За заряду комплексного іона комплекси бувають катіонними (комплекс з позитивним зарядом), аніонними (комплекс з негативним зарядом), нейтральними (комплекс з нульовим зарядом).
За типом лігандів комплекси бувають: ацидокомплексів, - лігандами є залишки кислот (Cl -. J -. Br -. CN -. HCO3 -. CO3 2-. С2 О4 2); гідроксікомплекси (ОН -); Аквакомплекси (H2 O); амінокомплекси (NH3); змішані, коли в комплекс входять декілька типів ліганд.
Звідси, для правильного написання формули комплексного з'єднання потрібно знати: заряд (ступінь окислення) комплексообразователя; заряд лігандів; координаційне число комплексоутворювача; іони зовнішньої сфери.
При написанні формул комплексного іона першим вказується символ комплексообразователя, потім вказуються нейтральні ліганди в порядку H2 O, NH3. Після нейтральних лігандів слідують аніонні ліганди. Аніонні ліганди перераховуються в порядку: Н -. Про -2. ВІН -. прості аніони, складні аніони неорганічних кислот, аніони органічних кислот.
Формули комплексних сполук читають строго справа наліво, дотримуючись у формулі порядок розташування лігандів. У назвах комплексних сполук спочатку називають аніон в називному відмінку, а потім катіон в родовому відмінку.
I. Якщо в з'єднання входить комплексний катіон. то спочатку називають ліганди по порядку розташування в комплексі, після чого слід назва комплексообразователя (російська назва елемента). У дужках римськими цифрами показують ступінь окислення комплексоутворювача. Нейтральні молекули, які виступають в якості лігандів, мають своє звичайне назва, крім аміаку - амін, води - аква, СО - карбоніл, NO - нітрозил. Негативно заряджені ліганди називають із закінченням на «о». Наприклад, Н - - гідридів, Про -2 - оксо, ОН - - гідроксо, F - - фторо, Cl - - хлоро, S -2 - тіо, CN - - ціано, SO4 -2 - сульфато, СН3 СОО - - ацетат , CNS - - тіоціанати, С2 О4 -2 - оксалатів. Якщо лигандов кілька, то спочатку називають іон зовнішньої сфери, потім ліганди грецькими числами: - 2-ді, 3-три і т.д.
Наприклад: назви комплексних катіонів
[З Н2 О (NH3) 5] Cl3 - хлорид пентааммінаквакобальта (III)
[Pt (NH3) 5 Cl] Cl3 - хлорид хлоропентааммінплатіни (IV)
[Pt H2 O (NH3) 2 OH] NO3 - нітрат гідроксодіаммінакваплатіни (II)
II. Якщо в з'єднання входить комплексний аніон. то спочатку називають ліганди за вказаною вище порядку. Далі називають комплексообразователь, використовуючи корінь його латинської назви з додаванням складу - «ат», після чого в дужках римськими цифрами вказують ступінь окислення комплексоутворювача. В останню чергу називається катіон зовнішньої сфери в родовому відмінку. наприклад:
K [Ag (CN) 2] - діціаноаргентат (I) калію
K2 [Cu Cl4] - тетрахлорокупрат (II) калію
K3 [Fe (CN) 6] - гексаціаноферрат (III) калію
Найменування нейтральних комплексів складаються з назви лігандів і російської назви комплексоутворювача в називному відмінку. При цьому валентність комплексообразователя не вказується. Наприклад: [CO (NH3) 3 Cl3] - тріхлоротріаммінкобальт.
[Pt (NH3) 2 Cl4] - тетрахлородіаммінплатіна.
Внутрішня і зовнішня сфера в молекулах комплексних сполук пов'язана іонним зв'язком. Комплексоутворювач і ліганди пов'язані ковалентним зв'язком по донорно-акцепторного механізму: ліганди грають роль донора електронної пари, а комплексоутворювач - роль акцептора. на вільної орбіталі якого розташовується електронна пара ліганду.
Дисоціація комплексних сполук йде в два ступені. Первинна дисоціація комплексних сполук йде за типом іонізації сильних електролітів і протікає без остачі: [Ag (NH3) 2] Cl → [Ag (NH3) 2] + + Cl -
Ліганди з комплексоутворювачем пов'язані міцнішим зв'язком і дисоціація комплексного іона протікає в меншій мірі. Цей вид дисоціації називається вторинною.
Мірою стійкості комплексного іона служить його константа нестійкості і позначається Кн.
Чим менше константа нестійкості, тим стійкіше комплекс.
Комплексні сполуки відіграють величезну роль в процесах життєдіяльності рослин і тварин. В організмі тварин і рослин комплексні сполуки виконують найрізноманітніші функції: накопичення і переміщення різних речовин і енергії; освіту і розщеплення хімічних зв'язків; участь в процесах дихання, фотосинтезу, біологічного окислення і ферментативном каталізі. Такі найважливіші в біологічному відношенні речовини, як гемоглобін, хлорофіл, ціанкоболамін, є внутрикомплексного, хелатними сполуками. У них чотири координаційних місця займає одна частинка, яка називається порфина, а комплексоутворювачем в гемоглобіні є - Fe +2. а в хлорофілі - Mg 2. в вітаміні B12 - Cо +3.
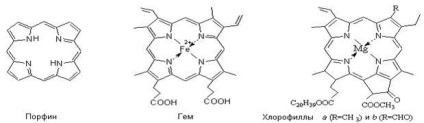
Комплекс заліза з порфіринів має плоске будова, в якому іон заліза з'єднаний 4 координаційними зв'язками з 4 піррольних кільцями, 5 зв'язок йде на приєднання білка глобіну, але шосте місце в координаційній сфері вільно. Це місце і займає молекула кисню, що переноситься гемоглобіном в процесі дихання.
Останнім часом встановлено, що комплексні сполуки платини і паладію надають гальмівну дію на розвиток злоякісних пухлин і з успіхом можуть застосовуватися для терапевтичних цілей, освіта хелатних (внутрішньокомплексних) з'єднань, використовуються при розчиненні солей в ниркових каменях і зниженні жорсткості води, зумовленої присутністю іонів кальцію і магнію. Відома висока бактерицидна активність деяких комплексних сполук срібла. Трилон Б (ЕДТА) здатний утворювати комплекси з багатьма металами, в тому числі з Са +2. Це дає можливість застосовувати його при захворюваннях, що супроводжуються надмірним відкладенням солей кальцію в організмі.