Мета: розглянути методи зберігання культури клітин, переваги кріозбереження клітин рослин, основні етапи, а також труднощі, що виникають у зв'язку з особливостями рослинних клітин.
1. Уповільнення зростання клітин
2. Основні етапи кріозбереження
2.1 Підготовка культури
2.2 Заморожування і зберігання
2.3 Розморожування і видалення кріопротектори
2.4 Рекультівірованіе клітин і їх оцінка після кріозбереження
1 В даний час здійснюється створення нових сортів рослин і регулярна зміна, що пов'язано, в першу чергу, з втратою сортом цінних ознак, появою нових попу-ляцій шкідників і збудників хвороб, зміною клімату, поч-ви і безліччю інших причин. Середній термін життя сорти пшениці та інших зернових культур зазвичай 5-10 років. Для виведення нових сор-тів і поліпшення старих потрібно різноманітний генетичний матері-ал. З метою збереження генофонду рідкісних та зникаючих видів, цін-них селекційних об'єктів і штамів - продуцентів економічно важ-них речовин розробляються методи створення колекцій і банків генів in vitro.
Основним джерелом генів є насіння. Для створення нових клітинних ліній. синтези-ючий цінні продукти, необхідно зберігання колекції клітин, тобто еталонів клітин-продуцентів, що володіють певними характерис-тиками. Для дослідження фізіологічних і біохімічних процесів в культивованих клітинах виникає необхідність тривалого збереженні-вати вихідних стандартних ліній клітин. Таким чином, для вирішення завдань потрібні методи зберігання культури клітин. Є два підходи до вирішення цієї проблеми: уповільнення росту клітин і зберігання в замороженому стані, тобто кріо-збереження (від грец. Kгyos - «мороз», «лід»). Завдання полягає в тому, щоб змінити кінетику росту культури і збіль-шити час між пересадками. Це дозволило б пересаджувати куль-тури раз в 3-4 місяці, рік і навіть рідше. В даний час уповільнення зростання під впливом факторів, що обмежують зростання, досягнуте лише для культур пагонів і рослин-регенерантів.
Найбільш дієвий шлях уповільнення зростання полягає в зниженні тим-ператури культивування в поєднанні зі зниженим освітленням. Ви-бір температури визначається холодостойкостью виду рослини. Так, для депонування колекцій картоплі використовувалася температура 10 о С, а яблуні 1 о С. Рекомендують для культур, нормально зростаючих при 20 - -25 ° С, використовувати 4-10 о С.
Зростання рослини можна також сповільнити додаванням до живильної сере-де осмотіков - маннита і сорбіту, підвищенням концентрації сахарози або внесенням в живильне середовище речовин, що гальмують зростання. У качес-тве останніх були використані гідразид малеїновий кислоти, 2,2 - метілгідразід бурштинової кислоти, хлорхолінхлорид, абсцизовая кисло-та. У вкрай рідкісних випадках для за-повільне зростання використовують зниження вмісту кисню - гіпоксію. Умови гіпоксії створюють застосовуючи суміш 90% азоту і 10% кисню. Іноді зменшують концентрацію кисню і одночасно знижують атмосферний тиск. Щоб уникнути виснаження поживних речовин і зневоднення обсяг агаризованому середовища для повільно зростаючих куль-тур збільшують. Якщо використовується рідка живильне середовище, її час від часу доливають, оскільки вона активніше випаровується.
2 кріозбереження - це глибоке заморожування і зберігання при наднизьких температурах, наприклад при температурі рідкого азоту (-196 ° С). Така температура гарантує стабільне збереження генетичних характеристик об'єктів практично протягом будь-якого терміну. Даний метод дозволяє зберігати найрізноманітніший матеріал - від ізольованих протопластів до зародків і насіння. В даний час глибоке замо-ражіваніе клітин, тканин і органів набуло широкого поширення в медицині і тваринництві. Інша працювати з рослинним мате-ріалом. Головні труднощі пов'язані зі специфікою рослинних клітин і з самим процесом глибокого заморожування. Рослинні клітини, що мають великі розміри, великі вакуолі і багато води, сильніше пошкоджуються при заморожуванні і наступному відтаванні. Поврежде-ня клітин пов'язано з утворенням льоду як всередині клітин, так і снаря пані. Лід зазвичай утворюється спочатку в зовнішньому розчині навколо клітин. Точка замерзання цитоплазми мінус 1 ° С, але клітини залишаються завмер-зшімі до -10-15 про C, так як до цього плазмалемма ще запобігає проникненню всередину кристалів льоду, що ростуть в зовнішньому розчині. Зростання кристалів льоду всередині клітини руйнує її мембрани.
Якщо температура знижується повільно, то клітина встигає втратити частину вільної води, яка виходить з неї і замерзає на поверхні-ти повільно зростаючих кристалів в зовнішньому розчині. Дуже швидке заморожування не супроводжується дегідратацією і призводить до виник-новению кристалів льоду в цитоплазмі. Повільне заморожування мо-же повністю виключити кристалізацію води в клітці, але при цьому неминуче відбувається значна дегідратація і стиснення протоплаз-ми. Зневоднення клітини відбувається внаслідок концентрування зовнішнього розчину через утворення в ньому льоду. Надмірний плазмо-ліз і викликаний ним осмотический стрес (особливо при подальшому деплазмолізу) призводить клітку до загибелі.
Таким чином, причиною загибелі клітин при заморожуванні є утворення льоду всередині клітини і механічне пошкодження її мембран, а також осмотичний стрес, обумовлений сильним зневодненням клітини. Отже, всі прийоми, використовувані в кріозбереження, на-мовані на певну збалансованість обох ушкоджують фак-торів. Виживання клітин рослин залежить від цілого ряду умов: гені-тичних і морфофизиологических їх особливостей і здатності до холо-довому загартовуванню, складу і кількості природних або штучно додаються криопротекторов, рівня проникності цих речовин і води, швидкості зниження температури і умов відтавання.
Робота по КРІОС-зберіганню культури клітин складається з наступних етапів (рис.18): - підготовка культури клітин,
- зберігання в рідкому азоті,
- рекультівірованіе і регенерація рослин.
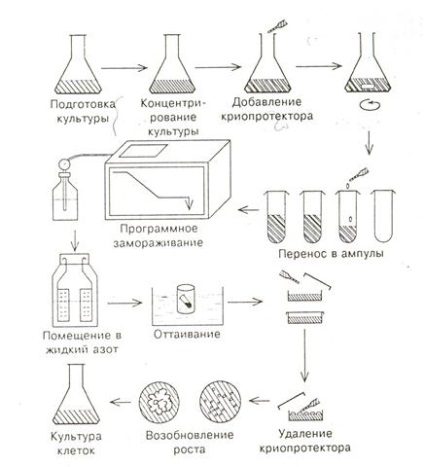
Рис.18. Етапи кріозбереження культури клітин
2.1 Зупинимося на основних етапах кріозбереження клітин. Експериментально показана можливість зберігання при наднизьких температурах культивованих клітин, ізольованих меристем, скінчиться-ков пагонів, зародків, пилку. Однак для кріозбереження настільки раз-Ліча між собою об'єктів, звичайно, потрібні різні підходи та умови починаючи з самого початкового етапу роботи. Найкраще методи кріозбереження розроблені для суспензійних культур. Дрібні мерістемоідние клітини більш стійкі до заморожування, ніж великі вакуолізірованние клітини. Те ж стосується мелкодіс-палої суспензій з пухкими агрегатами клітин в порівнянні з больши-ми щільними масами клітин. Клітини тропічних видів рослин можуть виявитися менш стійкими, ніж клітини рослин помірної зони. Для більш складно організованих структур, таких, як меристеми, зародилася-ши, ембріоїдів, потрібно оптимізація умов кожного етапу. Особливе значення має спеціальна підготовка культури, метою ко-торою є збагачення її клітинами меристематические типу. Тривале культивування в осмотіке, синхронізація ділення клітин, скорочення термінів пересадки сприяють зменшенню розмірів кліть-ки і збільшують їх виживання. На окремі культури позитивними-ве вплив на життєздатність клітин надає перед
ньо куль-тівірованіе з деякими амінокислотами, завдяки збільшенню рівня ендогенних цукрів в клітинах. Для суспензійних культур важливим мо-ментом підготовки є концентрування.
2.2Кріопротектори - це речовини, які знижують точку за-мерзанія, пов'язують внутрішньоклітинну воду і захищають клітини від механічного та осмотичного стресу. До них відносяться Дімі-тілсульфоксід (ДМСО), гліцерин, пролін і сахароза, яка є для рослин природним кріопротектор. Самі кріопротектори теж можуть викликати осмотичний стрес, тому підбираються їх оптимальним ні концентрації і поєднання.
ДМСО має унікальну проникаючу здатність, це особ-але важливо для великих щільних організованих структур, наприклад ме-Рісто. Для них етап підготовки полягає, головним чином, в перед- ньо культивуванні з додаванням в середу 5% ДМСО. Це забезпе-безпечує створення ефективних кріозахисних концентрацій по всьому апексу, розмір якого близько 0,3-0,5 мм.
Поряд з вибором криопротекторов, причому саме для даних кле-ток, дуже важливо знайти оптимальну програму заморожування. Разли-ють повільне поступове заморожування, швидке і сверхбис-троє. При повільному поступове заморожуванні температура в інтер-валі від 0 про до - 40 о знижується зі швидкістю 0,5-1 про в хв. При швидкому заморожуванні об'єкт в ампулі з кріопротектор занурюється відразу в рідкий азот. При надшвидкому заморожуванні сам об'єкт безпосереднім-ного вводиться в рідкий азот. Пилок можна заморожувати в сухому вигляді, запечатану в спеціальні пластмасові ампули, занурюючи їх у рідкий азот. Дані, отримані Кріобанку ІФР в Москві: показують, що бо- леї успішні результати дає программированное заморожування. Для цього потрібні спеціальні конструкції з робочою камерою, охолоджують-мій з запрограмованої швидкістю введенням парів рідкого азоту.
2.3 Розморожування і відновлення зростання культур - відповідальні і часто критичні етапи процесу. При занадто повільному відтаванні клітин в них відбувається повторне утворення льоду, що надає пошкоджені-ющее дію. Швидке відтавання запобігає цьому. Відтавання про-переводять погрожує ампули в теплу лазню (+40 о С) або капая на заморожені об'єкти теплу воду або середу для культивування. Однак у виняткових випадках більш доцільним виявляється повільне відтавання.
Після відтавання видаляється кріопротектор, що зазвичай робиться на холоді. Основна частина фізичних змін в клітинах відбувається при заморожуванні і відтаванні, однак тільки що розморожені клітини силь-но схильні до подальших пошкоджень і тому вимагають тща-ного «виходжування». Це починається з прямого пересаджування кле-ток на відновлює середу без промивання зі збереженням в клітинах криопротекторов. Часто кріопротектор видаляється спеціальними ус-ловіямі відмивання.
2.4 Стан культур оце-нить дуже складно, коли матеріал знаходиться на кріозбереження. Оцінка проводиться після відтавання і потрібна для ис-користування культур. Для швидкої оцінки культур найбільш придатні тес-ти на
життєздатність. Тести бажано проводити не відразу після відтавання, а на наступний день. Тести проводять періодично в процесі відновлення зростання для контролю за збільшенням вмісту жит-нездатних клітин або живої тканини.
Для зразків, видимих під мікроскопом в світлі, т. Е, клітинних суспензій, протопластів, невеликих калусних і організований-них структур, використовують фарбування флуоресцеіндіацетатом, феносафраніном. Для каллусов і щільних великих організовує-ванних структур використовують солі тетразолия.
Кількісною оцінкою виживання є зростання. Вивчають зростання культивованих клітин використовуючи будь-які стандартні методи вимірювання росту, включаючи приріст сирої та сухої маси, обсяг осіли клітин, оп-тичну щільність клітин, пряме мікроскопічне спостереження. Стан-дротяні цитологічні методи дозволяють оцінити ступінь поврежде-ний і відновлювальних процесу в, що відбуваються в тканинах. Ще більш точні дані отримують при дослідженні ультраструктури в електрон-ном мікроскопі.
З огляду на гетерогенність культур клітин, їх підготовку до заморожуванню-нию, не можна повністю виключити можливість прояву селективних переваг для будь-якої субпопуляції, особливо при низькій виживання після відтавання. Тому буває потрібна генетична, фізіологічна і біохімічна перевірка.
На етапі рекультівірованія іноді застосовують відомі прийоми ін-інтенсифікації росту клітин, щоб уникнути селекції можливих мутантних холодостійких клітин. Встановлено, що зберігання в рідкому азоті не впливає на виживання і відновлення клітинних культур. Рекультивованих після зберігання в рідкому азоті клітинні культури ідентичні вихідним і придатні для біотехнологічного застосування.
Таким чином, криобанк клітин, меристем, пилку забезпечує збереження генофонду не тільки культивованих in vitro штамів-продуцентів, а й рідкісних і зникаючих видів, що особливо важливо для вегетативно розмножуються рослин.
1. Способи збереження генофонду in vitro.
2. У чому перевага кріозбереження клітин?
3. Що таке кріопротектор?
4. Підготовка клітини до кріозбереження.
5. Як здійснюють заморожування і відтавання клітин?
Список використаної літератури
5. Калінін Ф.Л. Сарнацький В.В. Поліщук В.В. методи культури
тканин і клітин в фізіології і біохімії рослин. -Київ: Наукова Думка,
1980.
6.Валіханова Г.Ж. Рахімбаєв І.Р. Каржасова А.В. Бішімбаева Н.К.
Методичний посібник до практичних занять з культури тканин
рослин. -Алма-Ата: КазГУ, 1983.
7.Катаева П.В. Бутенко Р.Г. Клональне мікророзмноження растеній.-
М. Наука, 1983.
8.Глеба Ю.Ю. Ситін до К.М. Клітинна інженерія рослин. -Київ:
Наукова думка, 1984.
9.Бутенко Р.Г. Культура клітин рослин і біотехнологія. -М: Наука,
1986.
10. Клітинна інженерія / Бутенко Р.Г. Гусєв MB. Киркин А.Ф.
Біортехнологія, Т. 3. М .; Вища школа, 1987.
11. Біотехнологія рослин: культура клітин. - М;
Агропромиздат, 1989.
Мамирбекова Айгуль Кумекбаевна, Абубакірово Ажар Абдугаппаровна