Всі метали і металеві сплави за рідкісним винятком у твердому стані - тіла кристалічні, атоми (іони) розташовані в металах впорядковано один щодо одного на певних відстанях в залежності від природи металу. Ці відстані називаються параметрами кристалічної решітки.
В аморфних тілах атоми розташовані не впорядковано, а хаотично.
Метали якщо їх кристалізують звичайним способом - полікристалічні тіла, що складаються з великого числа дрібних, помітних лише під мікроскопом зерен (10 -1 -10 -6 см), по-різному орієнтованих по відношенню один до одного.
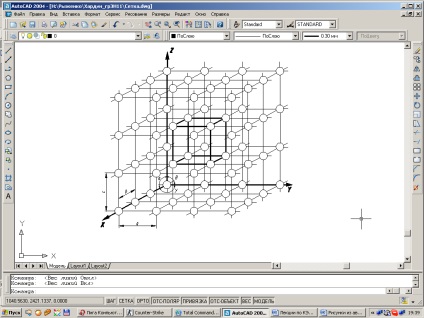
Отже, кожне зерно металу складається з безлічі таких геометричних тіл, які називаються елементарними осередками. У сусідніх зернах металу ці осередки орієнтовані по-іншому.
Мал. 1.1. Схема кристалічної решітки.
Атоми в вузлах кристалічної решітки вагаються щодо свого середнього положення з частотою близько 10 13 Гц не покидаючи своїх місць, за винятком деяких особливих випадків.
Що ж утримує атоми у вузлах кристалічної решітки, зберігаючи природу твердого стану матеріалу і його міцність.
Відомо, що атом будь-якого металу складається з тих, що оточують його кілька електронних оболонок, що несуть негативний заряд. Кожна оболонка заповнена строго певною кількістю сильно пов'язаних з атомом електронів і тільки на останній оболонці, знаходяться декілька слабосвязанних електронів з атомом. Їх число дорівнює валентності металу. За допомогою цих електронів атоми в металі встановлюють зв'язки один з одним. Зв'язок атомів між собою за допомогою валентних електронів називається металевої.
Але не всі електрони зовнішньої оболонки беруть участь в утворенні металевої межатомной зв'язку. Частина електронів, залишаючи ядра своїх атомів, йде в межузельние простір, утворюючи електронний «газ», тобто стають колективізованими.
Завдяки колективізованою електронам метали мають електро- і теплопровідністю, металевим блиском, надпровідність, термоелектронної емісією, пластичною деформацією і іншими металевими властивостями.
Сила зв'язку в металах визначається силами відштовхування і притягання між іонами і електронами. Атоми (іони) розташовуються на такій відстані один від іншого, при якому енергія взаємодії мінімальна.
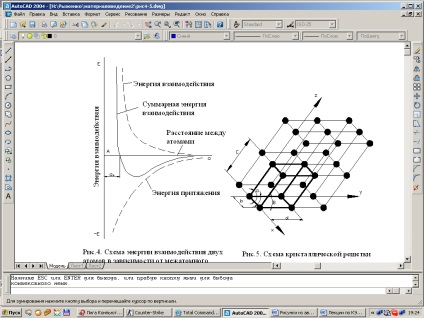
Більшість металів утворюють одну з наступних високосімметрічних решіток з
Мал. 1.2. Схема енергії взаємодії двох атомів залежно від міжатомної відстані.
щільною упаковкою атомів (рис. 1.3).
а, б) кубічну об'ємну центрированную (ОЦК) - грати мають залізо при звичайних температурних умовах, хром, вольфрам, ванадій, молібден, калій, натрій;
в) кубічну гранецентрированную (ГЦК) - грати мають нікель, мідь, алюміній, свинець, срібло, залізо при температурах 911-1392 ° С і ін. метали;
г) гексагональную щільно упаковану (ГПУ) - грати мають магній, цинк, кобальт, цирконій і титан при кімнатній температурі.
Для однозначної характеристики елементарних кристалічних ґрат, тобто її параметрів, необхідно знати: три ребра (a, b і c) і
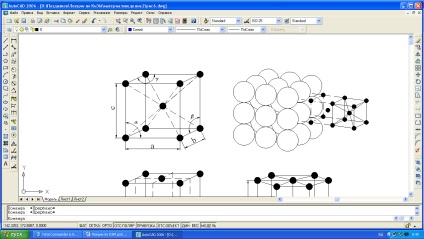
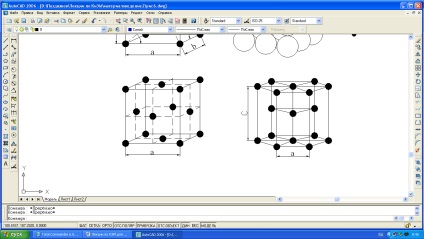
Мал. 1.3. Кристалічні решітки металів: а і б - кубічна об'емноцентрірованная (ОЦК); в - кубічна гранецентрированная (ГЦК); г - гексагональна щільноупакована.
три кути між осями (# 945 ;, # 946; і # 947;) (див. Рис.1.1). Параметри - відстані між центрами сусідніх атомів за обраним напрямом і вимірюються в нанометрів або Ангстрема А °, причому 1нм = 10А ° = 10 -9 м.
Як видно, що деякі метали в залежності від температурних умов існують з різними кристалічними гратами. Наприклад, залізо при температурах до 911 ° С має ОЦК-решітку, вище 911 ° С і до 1392 ° С має ГЦК-решітку і далі понад 1392 ° С аж до температури плавлення тисяча п'ятсот тридцять дев'ять ° С приймає форму ОЦК-решітки.
Здатність металу змінювати тип кристалічної решітки в залежності від температури називається аллотропией або поліморфізмом.
Поліморфні перетворення мають важливі значення в техніці, завдяки їм, виявляється можливим виробляти термічну обробку сталей і інших металів.
Неважко бачити, що щільність атомів в кристалічній решітці з різних площинах неоднакова (рис. 1.4).
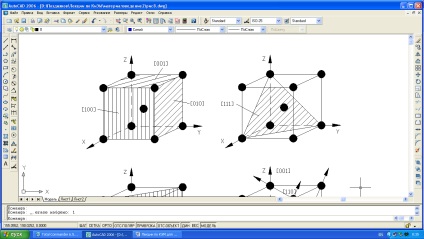
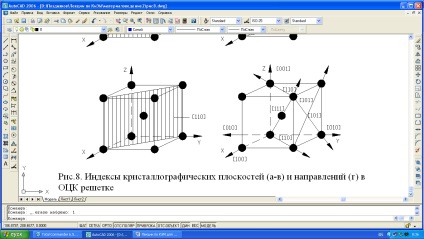
Мал. 1.4. Індекси кристалографічних площин (а-в) і напрямків (г) в ОЦК-решітці.
Так площину (100) в ОЦК-решітці належить один атом (1 / 4х4 = 1), площини (110) - 2 атома (1 / 4х4 + 1 = 2), то внаслідок неоднаковою щільності в різних площинах і напрямах решітки, властивості ( хімічні, фізичні, механічні) кожного монокристалла будуть неоднакові і це називається анізотропією. Отже кристал - тіло анізотропне.
Технічні метали - полікристалічні тіла, тобто складаються з великого числа анізотропних кристалів, які в більшості випадків неупорядоченно орієнтовані один до одного. Тому властивості у всіх напрямках більш-менш однакові, тобто полікристалічне тіло псевдоізотропно. Така уявна изотропность металу не буде спостерігатися при спрямованої кристалізації і значною холодної деформації.