Малі интерферирующие РНК
Огляд присвячений малим інтерферують РНК, які беруть участь в регуляції експресії генів
Малі интерферирующие РНК (siRNA)
Довжина siRNA 21-25 пар основ вони утворюються з дцРНК. Джерелом таких РНК можуть бути вірусні інфекції, введені в геном генетичні конструкції, довгі шпильки в складі транскриптов і двунаправленная транскрипція мобільних елементів.
дцРНК нарізаються РНКази Dicer на фрагменти довжиною 21-25 пар основ з виступаючими на 2 нуклеотиду 3'-кінцями, після чого одна з ланцюгів входить до складу RISC і направляє розрізання гомологічних РНК. У складі RISC присутні siRNA, відповідні як плюс, так і мінус-ланцюгах дцРНК. siRNA не мають власних генів і є фрагментами довших РНК. siRNA направляють розрізання РНК-мішені, оскільки повністю їй комплементарні. У рослин, грибів і нематод в процес придушення експресії генів залучені РНК-залежні РНК-полімерази. для якої siRNA служать ще і праймерами (затравки для синтезу нової РНК). Новоутворена дцРНК нарізається Dicer, утворюються нові siRNA, які є вторинними. Таким чином відбувається ампліфікація сигналу.
РНК-інтерференція
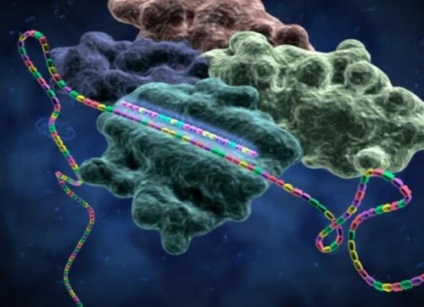
РНК-інтерференція
Розглянемо вищеописану схему РНК-інтерференції в динаміці
Роль в клітинних процесах
Яке ж значення siRNA в клітці?
siRNA залучені на захист клітини від вірусів. репресію трансгенів, регуляцію деяких генів і формування центромерного гетерохроматина. Важлива функція siRNA-придушення експресії мобільних генетичних елементів. Таке придушення може відбуватися як на рівні транскрипції, так і посттранскрипційна.
Геном деяких з вірусів складається з ДНК, у деяких же - з РНК, причому, РНК у вірусів може бути як одно-, так і двуцепочечной. Сам процес розрізання чужорідної (вірусної) мРНК в цьому випадку відбувається так само, як було описано вище, тобто шляхом активації комплексу ферментів RISC. Однак для більшої ефективності рослини і комахи винайшли своєрідний шлях посилення захисної дії siRNA. Приєднуючись до ланцюга мРНК, ділянку siRNA може за допомогою комплексу ферментів DICER спочатку добудувати другу ланцюжок мРНК, а потім розрізати її в різних місцях, створюючи таким чином різноманітні "вторинні" siRNA. Вони, в свою чергу, формують RISC і проводять мРНК через всі стадії, про які йшла мова вище, аж до її повного знищення. Такі "вторинні" молекули зможуть специфічно зв'язуватися не тільки з тією ділянкою вірусної мРНК, до якого була спрямована "первинна" молекула, але також і з іншими ділянками, що різко посилює ефективність клітинної захисту.
Таким чином, у рослин і нижчих тварин організмів siRNA є важливою ланкою своєрідного "внутрішньоклітинного імунітету", що дозволяє розпізнавати і швидко знищувати чужу РНК. У тому випадку, якщо в клітку проник РНК - вірус, така система захисту не дасть йому розмножитися. Якщо ж вірус містить ДНК, система siRNA буде заважати йому робити вірусні білки (так як необхідна для цього мРНК буде розпізнаватися і розрізати), і за допомогою цієї стратегії сповільнить його поширення по організму.
У ссавців же, на відміну від комах і рослин, працює і інша система захисту. При попаданні в "зрілу" (диференційовану) клітку ссавця чужий РНК, довжина якої більше 30 пар основ клітина починає синтез інтерферону. Інтерферон, зв'язуючись зі специфічними рецепторами на клітинній поверхні. здатний стимулювати в клітці цілу групу генів. В результаті в клітині синтезується кілька видів ферментів, які гальмують синтез білків і розщеплюють вірусні РНК. Крім того, інтерферон може діяти і на сусідні, ще не заражені клітини, блокуючи тим самим можливе поширення вірусу.
Як можна помітити, обидві системи багато в чому схожі: у них спільна мета і "методи" роботи. Навіть самі назви "interferon" і "(RNA) interference" походять від спільного кореня. Але є у них і одна дуже суттєва відмінність: якщо інтерферон при перших ознаках вторгнення просто "заморожує" роботу клітини, не дозволяючи (про всяк випадок) виробництво багатьох, в тому числі і "невинних" білків в клітині, то система siRNA відрізняється надзвичайною розбірливістю : кожна siRNA буде розпізнавати і знищувати тільки свою, специфічну мРНК. Заміна всього лише одного нуклеотиду всередині siRNA веде до різкого зниження ефекту інтерференції. Жоден з блокаторів генів, відомих досі, не володіє такою винятковою специфічністю по відношенню до свого гену-мішені.
Відкриття РНК-інтерференції дає нову надію в боротьбі зі СНІДом та онкологічними захворюваннями. Можливо, застосовуючи терапію siRNA разом з традиційною антивірусної терапією, можна досягти ефекту потенціювання, коли два впливу призводять до більш вираженого лікувального ефекту, ніж проста сума кожного з них, що застосовується окремо.
Для того, щоб використовувати механізм siRNA - інтерференції в клітинах ссавців, всередину клітин потрібно ввести вже готові дволанцюжкові молекули siRNA. Оптимальний розмір таких синтетичних siRNA при цьому становить ті ж 21-28 нуклеотидів. Якщо збільшити її довжину - клітини дадуть виробленням інтерферону і зниженням синтезу білка. Синтетичні siRNA можуть потрапити як в заражені, так і в здорові клітини, і зниження вироблення білків в незаражених клітинах буде вкрай небажаним. З іншого боку, якщо спробувати застосовувати siRNA менші, ніж 21 нуклеотид, різко знижується специфічність її зв'язування з потрібною мРНК і здатність до формування комплексу RISC.
Якщо вдасться тим чи іншим способом доставити siRNA, що володіє здатністю зв'язуватися з будь-яким ділянкою генома ВІЛ (який, як відомо, складається з РНК), можна спробувати не допустити його вбудовування в ДНК клітини господаря. Крім того, вчені розробляють шляхи впливу на різні етапи розмноження ВІЛ в уже зараженій клітині. Останній підхід не забезпечить лікування, однак може суттєво зменшити швидкість розмноження вірусу і дати загнаної в кут імунній системі шанс "відпочити" від вірусної атаки, і самої спробувати розправитися з залишками захворювання. На малюнку ті два етапи розмноження ВІЛ в клітці, які, як сподіваються вчені, можна заблокувати за допомогою siRNA, відзначені червоними хрестами (етапи 4-5 - вбудовування вірусу в хромосому, і етапи 5-6 - збірка вірусу і вихід з клітини).
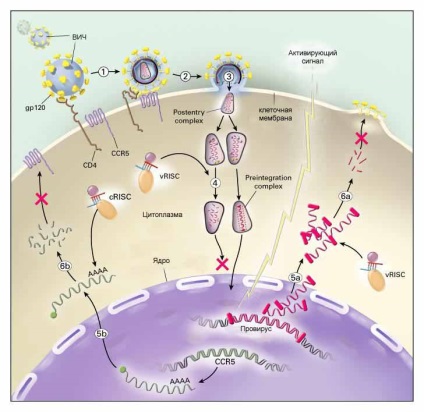
На сьогоднішній день, правда, все вищесказане стосується лише області теорії. На практиці терапія siRNA зустрічається з труднощами, обійти які вченим поки не вдається. Наприклад, в разі антивірусної терапії саме висока специфічність siRNA може зіграти злий жарт: як відомо, віруси мають здатність швидко мутувати, тобто змінювати склад своїх нуклеотидів. Особливо досяг успіху в цьому ВІЛ, частота змін якого така, що у людини, що заразилася одним підтипом вірусу, через кілька років може бути виділений абсолютно несхожий на нього підтип. В цьому випадку змінений штам ВІЛ автоматично стане нечутливим до siRNA, підібраною на початку терапії.
Старіння і канцерогенез

Як і будь-який епігенетичні фактор, siRNA впливають на експресію генів, які змушує "мовчати". Зараз з'являються роботи, в яких описані експерименти по виключенню генів, асоційованих з пухлинами. Гени вимикають (knock-down) саме за допомогою siRNA. Наприклад, китайські вчені за допомогою siRNA вимикали ген транскрипційного фактора 4 (TCF4), активність якого служить причиною синдрому Pitt-Hopkins (дуже рідкісне генетичне захворювання, що характеризується розумовою відсталістю і епізодами гіпервентиляції і апное) і інших розумових захворювань. У даній роботі проводилося вивчення ролі TCF4 в клітинах раку шлунка. Ектопічна експресія TCF4 знижує ріст клітин в лініях клітин раку шлунка, вимикання гена TCF4 за допомогою siRNA підвищує міграцію клітин. Таким чином, можна зробити висновок, що епігенетичні вимикання (сайленсінг) гена TCF4 грає важливу роль в освіті та розвитку пухлини.
Згідно з дослідженнями в Department of Oncology, Albert Einstein Cancer Center під керівництвом Leonard H. Augenlicht siRNA бере участь в виключенні гена HDAC4. що викликає пригнічення росту ракової пухлини товстої кишки, апоптоз і підвищення транскрипції p21. HDAC4 - це гістонові деацетілаза, яка є тканеспеціфічной, пригнічує диференціювання клітин і її експресія пригнічена протягом процесу диференціювання клітин. В роботі показано, що HDAC4 є важливим регулятором проліферації клітин товстої кишки (що має значення при раковому процесі), а її в свою чергу регулюють siRNA.
У Department of Pathology, Nara Medical University School of Medicine в Японії проводилися дослідження раку простати. Реплікативного старіння клітин це бар'єр проти неконтрольованого ділення і канцерогенезу. Короткоживучі діляться клітини (TAC) є частиною популяції клітин простати, з якої і утворюється пухлина. Японські вчені вивчали причини, за якими ці клітини долають старіння. В клітини простати в культурі були трасфеціровани junB siRNA. У цих клітинах спостерігається підвищений рівень експресії p53, p21, p16 і pRb, виявляється при старінні. Клітини в культурі, які показали знижений рівень p16, використовувалися для наступного етапу. Повторна трансфекція siRNA в TAC дозволила клітинам уникнути старіння при інактивації p16 / pRb. Крім того сайленсінг прото-онкогена junB за допомогою junB siRNA викликає інвазію клітин. На підставі цього був зроблений висновок, що junB є енхансерним елементом для p16 і сприяє клітинному старіння, перешкоджає малігнізації (озлокачествлению) TAC. Таким чином, junB є регулятором канцерогенезу в простаті і може бути метою для терапевтичного впливу. А регулювати його активність можна за допомогою siRNA.
Подібних досліджень проводиться безліч. В даний час siRNA- це не тільки об'єкт, а й інструмент в руках дослідника- лікаря, біолога, онколога, геронтолога. Дослідження зв'язку siRNA з онкологічними захворюваннями, з експресією вік-асоційованих генів- це найважливіше завдання для науки. Минуло зовсім небагато часу з моменту відкриття siRNA, а скільки з'явилося цікавих досліджень і публікацій, пов'язаних з ними. Можна не сумніватися, що їх вивчення стане одним із кроків людства до перемоги над раком і старінням.