Розчини займають проміжне положення між механічними сумішами речовин і індивідуальними хімічними сполуками, володіючи певними властивостями і тих і інших систем і в той же час значно відрізняючись від кожної з них.
Так в порівнянні із сумішами розчини є більш однорідними і в будь-якій своїй частині мають однакові фізичними властивостями і хімічним складом, як і з'єднання з абонентом.
У той же час багато речовин в розчинах, як і в механічних сумішах, зберігають незмінними частина властивостей, властивих їм в чистому вигляді. На відміну від індивідуальних сполук розчини володіють змінним складом і відрізняються природою зв'язку між своїми структурними одиницями. Якщо для хімічних речовин характерні ковалентні та іонні зв'язку, то в розчинах між їх компонентами присутні більш слабкі диполь-дипольні, іон-дипольні або ван дер Ваальсових взаємодії, а в деяких випадках - водневі зв'язку і донорно-акцепторні взаємодії.
Таким чином, процес розчинення можна розглядати як просте механічне розподіл одного речовини в іншому.
Дмитро Іванович Менделєєв
(1834 - 1907).
Воістину великий вчений. Ні, здається, жодної галузі хімії, в яку б він не вніс свій внесок. Найбільш відомі його роботи, крім періодичного закону, це відкриття «температури абсолютного кипіння» (критичної точки), розробка фізико-хімічної (гідратної) теорії розчинів, формулювання узагальненого газового закону. Ще одним головною справою свого життя Д. І. Менделєєв вважав підручник «Основи хімії».
При розчиненні має місце фізико-хімічну взаємодію розчиняється речовини з молекулами розчинника, в результаті якого руйнується його вихідна структура і відбувається утворення нової структури, властивої розчину. При цьому розрізняють фізичну і хімічну стадії розчинення речовини, які протікають одночасно.
На фізичної стадії відбувається процес подрібнення (диспергування) розчиняється речовини до окремих молекул або іонів і їх рівномірний розподіл у всьому об'ємі розчину. Здійснюється вона за рахунок дії молекул розчинника на речовина і протікання процесу дифузії.
На цій стадії енергія завжди витрачається, тому що вона необхідна для розриву зв'язків в кристалічній решітці твердого речовини або міжмолекулярних зв'язків при розчиненні рідини.
Покажемо механізм цього процесу на прикладі розчинення в Н2 Про солі KCl, що має іонну кристалічну решітку (рис. 18).
Диполі розчинника орієнтуються відповідним чином щодо іонів кристалічної решітки на її поверхні і в результаті свого теплового руху і коливального руху іонів послідовно виривають їх з вузлів решітки і переводять в розчин.
Чим міцніші зв'язки в кристалічній решітці, тим більша кількість енергії потрібно затратити на її руйнування. Міжмолекулярні зв'язки в рідинах, як правило, слабкіше ніж у твердих речовинах, тому при їх розчиненні енергії затрачіва-
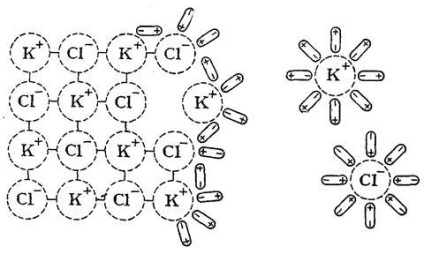
Мал. 18. Механізм розчинення іонного з'єднання (KCl) в воді
ється набагато менше. У газах молекули практично не пов'язані між собою, тому на фізичної стадії їх розчинення енергія не витрачається.
На хімічної стадії розчинення відбувається взаємодія частинок розчиненої речовини (молекул або іонів) з молекулами розчинника і утворюються хімічні сполуки: гідрати (якщо в ролі розчинника виступає Н2 О) або сольвати (якщо розчинником виступає будь-яка інша рідина).
Залежно від природи розчиненої речовини сольвати (гідрати) можуть утворюватися як в результаті фізичних взаємодій: іон-дипольного (при розчиненні речовин з іонним структурою) і диполь-дипольного (при розчиненні речовин з молекулярною структурою), так і хімічних.
Хімічні взаємодії здійснюються за рахунок утворення донорно-акцепторних зв'язків. При цьому іони розчиненої речовини є акцепторами, а молекули розчинника (Н2 О, NH3) - донорами електронних пар. Утворені таким чином гідрати називаються інакше Аквакомплекс. [Cu (H2 O) 6] 2+. [Al (Н2 О) 6] 3+. Їх освіту в розчинах часто супроводжується зміною забарвлення. Так розчинення безводного мідь (II) -сульфата білого кольору призводить до появи інтенсивної блакитного забарвлення. Гідратів оболонки полярних молекул органічних сполук з'являються в результаті утворення водневих зв'язків між їх функціональними групами і молекулами води.
Внаслідок утворення гідратів (сольватов) при розчиненні багатьох речовин має місце контрактація - стиснення обсягу системи через її самоущільнення (особливо в разі концентрованих розчинів). При цьому обсяг отриманого розчину буде менше суми обсягів розчинника і розчиняється речовини (якщо тільки останнє не є газом).
Освіта гідратів (сольватних) оболонок завжди супроводжується виділенням енергії. При гідратації іонів кількість виділилася енергії і число утримуваних молекул води залежать від величини їх заряду і радіусу.
Чим більше заряд іона і менше його радіус, тим більша кількість енергії виділяється і тим більш стійкою буде утворилася гидратная оболонка (рис. 19).
Мал. 19. Залежність розмірів гідратних оболонок іонів від величини їх радіусу
Якщо речовина в розчині знаходиться у вигляді молекул, то кількість виділеної при гідратації енергії пропорційно полярності його молекул.
В ході теплового руху частинки розчиненої речовини в розчині переміщається разом зі своїми гідратний (сольватного) оболонками, які складають з ними одне ціле.
У більшості випадків утворилися гідратів (сольватні) оболонки є неміцними і легко руйнуються вже при слабкому нагріванні або при випаданні речовин з розчину. Але іноді гідратів сполуки настільки стійкі, що випадають з розчину у вигляді кристалів, які називаються інакше кристалогідрату. а що міститься в них Н2 О - кристаллизационной.
У хімічних формулах кристаллогидратов молекули Н2 Про пишуться через точку (табл. 5). З цих формул видно, скільки молекул Н2 Про оточують одну молекулу речовини.
Таблиця 5. Формули і тривіальні назви кристалогідратів
При нагріванні (іноді досить сильному) кристалогідрати руйнуються, а кристаллизационная Н2 Про випаровується.
Фізична і хімічна стадії процесу розчинення протікають одночасно. Сумарний тепловий ефект при розчиненні речовини визначається співвідношенням між двома цими стадіями.
Якщо на фізичної стадії енергії витрачається більше, ніж її виділяється на хімічній стадії, то при розчиненні такої речовини температура розчину буде знижуватися, а енергія, в цілому, витрачатися. Це спостерігається, наприклад, при розчиненні NaCl, NH4 NO3.
Якщо ж на фізичної стадії енергії витрачається менше, ніж виділяється на хімічній стадії, то при розчиненні таких речовин температура розчину, навпаки, буде підвищуватися, а енергія, в цілому, виділятися. Особливо добре це спостерігається при розчиненні в воді NaOH, KOH, H2 SO4.
Якщо на фізичної стадії витрачається приблизно стільки ж енергії, скільки виділяється на хімічній, то температура розчину при розчиненні такої речовини практично не буде змінюватися.
При розчиненні газів теплота завжди виділяється, тому що на фізичної стадії енергія не витрачається.
Теплові ефекти розчинення більшості речовин незначні, тому помітного розігрівання або охолодження розчинів, як правило, не спостерігається. Однак в деяких випадках, наприклад, при розчиненні в Н2 Про гідроксидів лужних металів або H2 SO4. відбувається настільки сильне розігрівання розчину, що він може навіть закипіти. Тому при приготуванні водних розчинів кислот і лугів потрібна особлива обережність. Зокрема, при отриманні розведеного розчину H2 SO4 потрібно доливати невеликими порціями концентровану кислоту в Н2 О, а не навпаки.
При розчиненні NaCl або NH4 NO3 температура розчину може, знизитися до мінусової.
Теплоту, що виділяється або поглинається при розчиненні 1 моля речовини називають його теплотою розчинення (Qраств.).
Розчинність речовин.
Фактори, що впливають на розчинність
Одні речовини краще розчиняються в тому чи іншому розчиннику, інші гірше. Вважається, що абсолютно нерозчинних речовин немає. Кожне речовина здатна до розчинення, нехай навіть в деяких випадках і в дуже незначних кількостях (наприклад, ртуть у воді, бензол в воді).
На жаль, до теперішнього часу, немає теорії, за допомогою якої можна було б передбачити і обчислити розчинність будь-якої речовини в відповідному розчиннику. Обумовлено це складністю і різноманіттям взаємодії компонентів розчину між собою і відсутністю загальної теорії розчинів (особливо концентрованих). У зв'язку з цим необхідні дані по розчинності речовин отримують, як правило, досвідченим шляхом.
Кількісно здатність речовини до розчинення характеризується найчастіше розчинність або коефіцієнтом розчинності (S).
Розчинність (S) показує скільки грамів речовини може максимально розчинитися за даних умов (температурі, тиску) в 100 г розчинника з утворенням насиченого розчину.
При необхідності коефіцієнт розчинності визначається і для іншої кількості розчинника (наприклад, для 1000 р, 100 см 3. 1000 см 3 і т.д.).
За розчинності все речовини в залежності від своєї природи діляться на 3 групи: 1) добре розчинні; 2) мало розчинні; 3) погано розчинні або нерозчинні.
Коефіцієнт розчинності для речовин першої групи більше 1 г (на 100 г розчинника), для речовин другої групи лежить в інтервалі 0,01 - 1,0 г і для речовин третьої групи S <0,01 г.
На розчинність речовин впливають багато факторів, головними з яких є природа розчинника та речовини, що розчиняється, температура, тиск, наявність в розчині інших речовин (особливо електролітів).