Внаслідок близькості властивостей лантаноїдів їх розділі - ня - складне завдання. Застосовувалися раніше способи поділу-лення були засновані головним чином на відмінності у розчині-рімості з'єднань лантаноїдів. В результаті великого числа дрібних кристалізацій або дрібних осаджень (іног-да досягали декількох тисяч) отримували окремі еле-менти більшою чи меншою мірою чистоти. Для відділення деяких елементів використовували здатність їх окіслять- ся до чотирьохвалентного стану (Се, Pr, Tb) або вос-станавливаются до валентності 2 (Sm, Eu, Yb). У цьому випадку поділ полегшується завдяки значним від-лічіям у властивостях з'єднань лантаноїдів зі ступенем окислення +4 і +2 і з'єднань лантаноїдів зі ступенем окислення +3.
Сучасні схеми поділу лантаноїдів засновані на використанні більш ефективних методів: рідинної Кекст-ракции і іонного обміну. Старі "класичні" методи дробового осадження і кристалізації практично не ис-товують в даний час.
Методи виборчого окислення і відновлення при-міняють в деяких схемах поділу.
Окислення церію до чотирьохвалентного стану примі-няют для відділення його від інших лантаноїдів. Церій легко окислюється киснем в процесі сушіння суміші гідроксидів РЗЕ на повітрі при 120 - 130 ° С або при пропущенні віз-духу через нагріту суспензію гідроксидів. Застосовують так-же інші окислювачі: хлор, пероксид водню. Після оки-хування Се3 + до Се4 + гідроксиди тривалентних лантаноїдів розчиняють в розведеною (5 - 10% -ної) азотної або со-ляной кислоті, в той час як гідроксид чотиривалентний церію (Се02 • яН20) залишається в осаді. Останній містить 94 - 96% Се02.
Для отримання більш чистого продукту використовують изби рательную екстракцію Ce (N03) 4 з 6 - 8 н. розчину азот-ною кислоти трибутилфосфатом або іншими екстрагентами.
Відновлення до ступеня окислення +2 застосовують для відділення самарію, європію та ітербію з збагачених ними фракцій. Іони Sm2 +, Eu2 +, Yb2 + проявляють схожість з іона-ми стронцію і барію. Так, їх сульфати мало розчинні в відміну від сульфатів лантаноїдів (+3). Як віднов-новітелей використовують цинк, амальгаму цинку, амальгаму натрію.
Окислювально-відновні потенціали Sm, Eu і Yb (по відношенню до водневого електроду) наведені нижче, В:
Sm37Sm2 + -1,72; Yb3 + / Yb2 + -1,15; Eu3 + / Eu2 + -0,43;
Zn2 + / Zn -0,76; Na + / Na (Hg) -1,86.
З наведених значень потенціалів слід, що іони Еі3 + можна вибірково відновити до Еі2 + цинковим пилом, що не відновлювальної іони Sm3 + або Yb3 +. Віднов-лення ведуть в солянокислом розчині. При подальшому додаванні в розчин сірчаної кислоти осідає малораст-ворімий EuS04.
Спільне відновлення трехзарядних іонів європію і самарію можливо амальгамою натрію, з якої перемішують-ють оцтовокислий розчин, содежащій розділяється суміш лантаноїдів:
L «(CH3COO) 3 + 3Na (Hg) = Zn (Hg) + 3CH3COONa. (11.4)
Відновлені елементи витягують з амальгами обра-боткой її соляною кислотою. Подальше поділ євро-Пія і самарію можна потім здійснити відновленням їв-ропія цинковим пилом.
Ефективний варіант відділення европия від інших РЗЕ складається у виборчій екстракції трехзарядних іонів РЗЕ Катіонообменная екстрагентів - ді-2-етілгексілфосфорной кислотою (Д2ЕГФК), практично не екстрагуючої іони Еі2 +
Поділ РЗЕ екстракцією
В даний час екстракційні методи стали основних зас-ми в схемах поділу РЗЕ. У промисловій практиці для поділу переважно використовують фосфорорганічні екстрагентів - ТБФ, Д2ЕГФК і карбонові кислоти. Розділі-ня засноване на закономірну зміну значень коеффіці-тів розподілу в ряду лантаноїдів.
Нижче екстракційне поділ РЗЕ розглянуто на при-міру використання найбільш поширеного екстрагента - ТБФ. Характеристика ТБФ як екстрагента дана в гл. 2. У промисловій практиці поділ РЗЕ екстракцією ТБФ здебільшого здійснюють з азотнокислим розчинів,
містять нітрати РЗЕ. Екстракція протікає з освітньої-ням трісол'вата:
^ Л (водн) + 3N03 (BoaH) + ЗТБФ (0РГ) <—-
L / i (N03) 3 • ЗТБФ (0РГ); (Ц.5)
D = ^ C [N03] ^ H) • [ТБФ] (ОРГ),
Де Кс - константа рівноваги реакції екстракції.
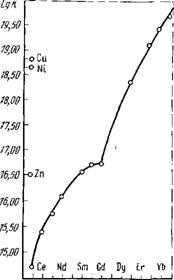
Значення коефіцієнта розподілу в сісмете ТБФ - HN03 при високих концентраціях HN03 (11 - 15м / л) неодмінно-ривно зростають зі збільшенням атомного номера лантаноі-да. Однак в розчинах з концентрацією HN03 нижче 5м / л відбувається інверсія (звернення) закономірності зміни коефіцієнтів розподілу для ряду европий - лютеций (рис. 82). Це пояснюється виявляється при низькій киць - jj
Лотності зростанням енергії гідратації в ряду важких РЗЕ, що ускладнює витіснення мо-лекул води з гідратної Оболо-чки іона молекулами ТБФ. ft0
Ржс.82. Залежність коефіцієнта розбраті - jq-3 ділення (£>) РЗЕ від порядкового номера t
> 7 59 61 63 65 67 69 71
При екстракції ТБФ
При високій кислотності (більше 12 м / л) середня величи-на коефіцієнта поділу для сусідніх елементів від лан-тана до тербія 0 = Dz + 1 / Dz = 1,9; для елементів від тербія до лютецію ця величина нижче. Тому для всієї групи РЗЕ можна прийняти 0 = 1,5. Для легких РЗЕ (La, Ce (IIl), Рг, Nd, Pm) кеффіціента розподілу мало змінюються при збільшенні концентрації їх в розчинах від 5 - 10 до 70 - 100 г / л: для середніх P33 (Sm, Eu, Gd) і важких елементів
(Иттриевая група) коефіцієнти розподілу істотно залежать від концентрації РЗЕ в водної фазі.
РЗЕ добре екстрагується ТБФ також з слабокислих ні-тратних розчинів в присутності висалівателей - нітратів алюмінію, натрію, кальцію, літію.
При використанні екстракції ТБФ для поділу РЗЕ на підгрупи процес ведуть з нітратних розчинів з концент-рацією HN03 7 - Юм / л. При цьому ітрій потрапляє в під-групу важких РЗЕ (Dy - Lu).
Крім нітратних розчинів для поділу РЗЕ екстрак-цією ТБФ використовують роданідного-хлоридні розчини. У них РЗЕ присутні в складі комплексів Ln (SCN) 3 і Ln (SCN) 2Cl, стійкість яких підвищується від лантану до Лютецію. Екстрагуються комплекс має склад Ln (SCN) 3 # 9632; • «ТБФ, п = 3-І.
У практиці поділу РЗЕ екстракцій процес здебільшого проводять в каскаді екстракторів типу змішувач - відстійник. Використовують систему повного противотока, кото-раю складається з екстракційної і промивної секцій і сек-ції реекстаракціі (див. Рис. 83). Загальна кількість ступенів каскаду 50 - 90.
Вихідний розчин, содежащій розділяється суміш, посту-Пает в середню частину каскаду. Очевидно, що для розділі-ня п елементів суміші буде потрібно проведення п - 1 після-послідовно операцій або п - 1 екстракційних каскадів.
Спочатку в режимі повного противотока проводять
Вихідний розчин РЗМ (А * в)
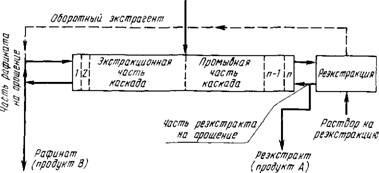
Р «с.83. Схема поділу РЗЕ екстракцією в системі повного противотока
Поділ РЗЕ на підгрупи: легкі РЗЕ (La, Се, Pr, Nd), середні (Sin, Eu, Gd, Tb) і важкі (Dy - Lu + Y). Потім ведуть подальше розділення в кожній з підгруп.
Відповідно до цього розрахунок першого каскаду проводять, орієнтуючись на поділ неодиму та самарію (використовуючи для розрахунку значення Psm / Nd)> ПРИ розрахунку другого каскаду орієнтуються на поділ по лінії тербий - діспрозій (використовують значення РРУ / т') -
При груповому поділі промивних розчином здебільшого служить азотна кислота.
В інших варіантах поділу РЗЕ, зокрема поділу-лення бінарних сумішей (А + В), наприклад неодиму та сама-рія, використовують каскад з обмінної промиванням. У цьому слу-чаї в промивної каскад повертають частину екстракту, содер-жащего краще екстрагуються компонент, наприклад В. При цьому в промивальному каскаді в результаті контакту фаз компонент В витісняє з органічної фази домішка компонен-та А. Це сприяє отриманню більш чистого компонента В, зменшуються відносні витрати розчину для промивання і екстрагента.
Поділ РЗЕ методом іонообмінної хроматографії
Як зазначено вище, в даний час рідинна Кекст-ракции - основний спосіб поділу РЗЕ. Ионообменная хроматографія - додатковий метод, який використовується для отримання індивідуальних РЗМ високого ступеня чистоти, переважно важких.
Для поділу лантаноїдів методом іонообмінної хрому-тографіі застосовують різні типи катіонітового смол (в СРСР катионит марки КУ-2). Вони являють собою сильно кислотні катіоніти, одержувані спільної полімеризацією стиролу і дивинилбензола і містять активні групи - S03H. Поділ здійснюють здебільшого методом елю - ентной хроматографії.
Спорідненість іонів лантаноїдів до смолі убуває від La3 + до Lu3 +, т. Е. В порядку зменшення розміру гідра тірован іонів. Однак спорідненість до смоли іонів РЗЕ дуже близько, що не забезпечує досить ефективного поділу. Найкраще поділ досягається при використанні елюіруются - щих розчинів, що містять органічні сполуки, обра-зующие з іонами РЗЕ комплекси різної стійкості.
Вимивання відбувається в послідовності, відпо-ють міцності аніонних комплексів лантаноїдів. У міру руху вимиває розчину уздовж колонки (або ряду по-отже з'єднаних колонок) суміш катіонів поділу-ляется на окремі сорбційні зони (смуги), переміщаю-щіеся з певною швидкістю до виходу колонки. Для ви-миванія застосовують різні органічні сполуки, про-разующіе комплекси з лантаноїдами: лимонну кислоту, ніт- рілотріуксусную кислоту (НТА) і етилендіамінтетраоцтової кислоти (ЕДТА). Останню найбільш широко застосовують при хроматографическом поділі РЗЕ. ЕДТА відноситься до клас-су а-амінокислот. Вона являє собою чотирьохосновним кислоту з двома атомами азоту:
Ноос - СНА / CHj - СООН
N - CHj - СН2 - N ноос - сн / ЧСНг - СООН.
Скорочено формулу ЕДТА позначають H4V. Двонатрієва сіль цієї кислоти має технічну назву "трилон-Б".
З трехзаряднимі іонами лантаноїдів ЕДТА утворює внут - рікомплексние з'єднання (хелати), в яких атоми азоту пов'язані з іоном лантаноида координаційними зв'язками
СН2СООН N - СН2СОО -
N - СН2СОО - СН2СОО-
Константу стійкості цих комплексних сполук оп-чати з рівняння:
Ln3 + + HV3- z ± H (Lnv); (11.9)
[Ln 3 +] • [HV3-] Як видно з рис. 84, константи стійкості у когось комплексів лантаноїдів з ЕДТА збільшуються від лантану до лю-тецію, т. Е. Зі зростанням порядкового номера елемента. Константи стійкості комплексів двох сусідніх РЗЕ отли-зустрічаються одна від одної в середньому в 2,4 рази. Це обумовлюються ливает велику вибірковість дії етілендіамінтет - рауксусной кислоти при її застосуванні для елюювання ка-тионов РЗЕ зі смоли.
РЗЕ поділяють в системі, що складається з ряду послідовно-тельно з'єднаних колонок, заповнених смолою. Перші одна або дві колонки служать для насичення смоли катіонами РЗЕ, наступні колонки - розділові. В процесі елюювання в них утворюються сорбційні смуги.
La Pr Pm Eu ТЬ Елементи
Ріс.84. Залежність констант стійкості До комплексів РЗЕ з ЕДТА від поряд-кового номера елемента
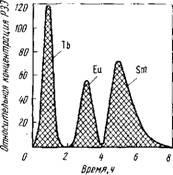
Pmc.8S. Криві вимивання тербія, европия і самарію, сорбованих на смолі, 0,26 М розчином ЕДТА; рН = 3,62
В колонках для насичення смолу спочатку заряджають іонами NH + (т. Е. Застосовують смолу в NHj-формі). У розділових колонках застосовують смолу в Си2 + -форме. Іони Си2 + грають в цьому випадку роль іона-сповільнювач, що сприяє краще-му поділу. Іони міді утворюють з ЕДТА більш міцні комплекси, ніж більшість іонів лантаноїдів (див. Рис. 84). Тому при проходженні вимиває розчину, содер-жащего комплексні іони РЗЕ з ЕДТА, через розділову колонку іони міді переходять в розчин, витісняючи іони РЗЕ з розчину в смолу і цим уповільнюючи їх просування. Це забезпечує високу концентрацію іонів РЗЕ в смолі.
Зазвичай працюють з вимивається розчином (Елюат), зна-чення рН якого доводять до 3,5 - 8,5 (низькі рН при поділі легких РЗЕ, більш високі - для важких РЗЕ) нейтралізацією гідроксидом амонію. Отже, елюант містить амонійну сіль ЕДТА. Так як амонійні солі комплексних кислот лантаноїдів з ЕДТА і мідні комплекси порівняно малорастворіми, для елюаціі застосовують раст-злодії ЕДТА малій концентрації (5 - 10 г / л). При великих концентраціях виділяються солі, забивають пори між зер-нами смоли, що призводить до порушення нормальної роботи. Мала концентрація ЕДТА в елюанте обмежує виробляй-ність процесу поділу, так як в фільтраті, вите-розкаювана з колонки, низька концентрація РЗЕ.
На виході з системи колонок фільтрат збирають окремих-ними фракціями. На рис. 85 показані криві вимивання рас-твором ЕДТА для випадку поділу трьох елементів. Перша хвиля відповідає виходу тербія, друга - европия, тре-тя - самарію, що узгоджується з порядку спадання міцністю комплексних сполук в ряду Tb - Eu - Sm.
Для регенерації ЕДТА розчини подкисляют до рН = 0,5 * 1. При цьому комплексні сполуки лантаноїдів руйнують-ся і осідає малорастворимая ЕДТА.
Якщо початкова питома завантаження (відношення маси сор-бірованной на смолі суміші поділюваних іонів до загальної маси смоли) невелика (нижче 5% маси смоли), а загальна довжина колонок для поділу досить велика, то виходять з колонки фракції фільтрату містять тільки один з разде- ється лантаноїдів.
Загальні схеми повного поділу
Застосовують різні схеми повного поділу РЗЕ, в яких поєднуються описані методи. Як приклад на рис. 86 приведена схема поділу елементів Регіна Дерієва групи. На поділ зазвичай надходить суміш гідроксидів, очищена від домішок інших елементів. Спочатку з суміші може бути виділений церій методом окислення. Потім проводять поділ методом противоточной екстракції на три фракції: легкі РЗЕ (La, Се, Pr, Nd), середні РЗЕ (Pr, Nd, Sm, Eu) і фракцію, збагачену гадолинием й е-ментами иттриевой групи (Nd, Sm, Eu , Gd + Yb). З другої і третьої фракцій можна виділити самарій і европий віднов-вою амальгамою натрію і розділити їх, як описано вище. Поділ елементів в кожній з виділених фракцій проводять, використовуючи методи екстракції і іонообмінної хроматографії.
При поділі елементів иттриевой підгрупи методом екстракції виділяють ітрій (наприклад, використовуючи екстрак-цію в хлоридно-роданідного системі) і дві фракції: Gd, Tb, Dy, а Но, Er, Tu, Tb, Lu. Подальший поділ ведуть з
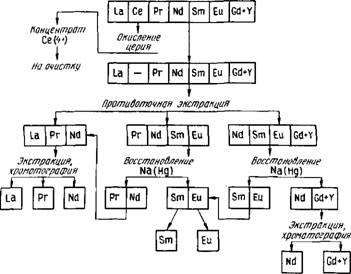
Ркс.86. Принципова схема поділу РЗЕ церієвої групи
Використанням екстракції (методи повного противотока або полупротівотока) і іонообмінної хроматографії. Иттербий виділяють відновленням з нітратних розчинів амаль-гамою натрію.