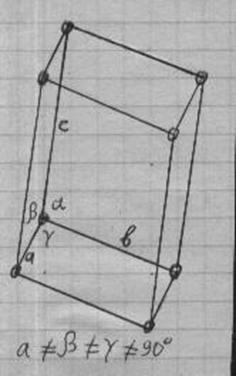
Мідний купорос CuSO 4 кристалізується з водних розчинів сульфату міді (див. Нижче) і являє собою яскраво-сині кристали триклинной системи з параметрами решітки: а = 7, 15 # 506 ;. b = 10. 70 # 506 ;. з = 5. 97 # 506; ; a = 97 ° 44 ', # 946; = 125 ° 20 ', # 947; = 94 ° 19 '; щільність 2, 29 г / см 3.
При нагріванні вище 105 ° С плавиться з втратою частини кристалізаційної води і переходить CuSO 4. 3 Н 2 О (блакитного кольору) і CuSO 4. Н 2 О (білого кольору). Повністю зневоднюється при температурі 258 ° С. При дії сухого NH 3 на CuSO 4 утворюється CuSO 4. 5NH 3. обмінює у вологому повітрі NH 3 на Н 2 О. З сульфатами лужних металів CuSO 4 утворює подвійні солі типу Me 2 SO 4. CuSO 4. 6H 2 O. пофарбовані в зелений колір.
У промисловості мідний купорос виходить розчиненням металевої міді в нагрітій розбавленою H 2 SO 4 при продуванні повітря: Cu + H 2 SO 4 + ½ O 2 = CuSO 4 + H 2 O. Він є також побічним продуктом електролітичного рафінування міді.
Мідний купорос - найважливіша технічна сіль міді. Він застосовується при отриманні мінеральних фарб, просочення деревини, для боротьби з шкідниками і хворобами рослин в сільському господарстві, для протруювання зерна, при виробленні шкір, в медицині, в гальванічних елементах; служить вихідним продуктом для отримання інших сполук міді.
Сульфат міді (сірчанокисла мідь) CuSO 4 - безбарвні кристали щільністю 3, 64 г / см 3. При нагріванні дисоціює: CuSO 4 = CuO + SO 2 + ½ O 2 з утворенням в якості проміжного продукту основного сульфату CuO. CuSO 4. При 766 ° С тиск дисоціації CuSO 4 досягає 287 мм. ртутного стовпа, а CuO. CuSO 4 - 84 мм. ртутного стовпа. Розчинність CuSO 4 в грамах на 100 гр. води становить: 14 (0 ° С); 23, 05 (25 ° С); 73, 6 (100 ° С). У присутності вільної H 2 SO 4 розчинність знижується. При рН 5, 4 - 6, 9 CuSO 4 гідролізується з утворенням основних солей. CuSO 4 дуже гігроскопічна, тому застосовується як осушуваних речовина; приєднуючи воду, синіє, що іноді використовується для виявлення води в спирті, ефірі та інших.
Мідний купорос - яскраво-сині кристали.
При нагріванні мідний купорос втрачає воду і перетворюється в сірий порошок. Якщо після охолодження накапати на нього кілька крапель води, то порошок знову придбає синє забарвлення.