Д ля розуміння хімічного характеру того чи іншого речовини необхідне знання про електронну будову атомів, що його утворюють. Згідно Періодичному закону, властивості елементів і утворених ними сполук визначаються зарядом ядер їх атомів. Розташування хімічних елементів в періодичної системі відповідає електронною будовою їх атомів.
Дані методичні вказівки призначені для вивчення електронної будови атомів і придбання навичок визначення властивостей елементів по їх розташуванню в Періодичній системі елементів.
будова атома
розглядаючи питання про електронну будову атомів, необхідно розрізняти вільні атоми, під якими розуміють атоми настільки віддалені один від одного, що не взаємодіють між собою, і атоми в твердих тілах, які взаємодіють між собою, утворюючи хімічні зв'язки. Для того, щоб зрозуміти характер їх взаємодії, необхідно спочатку зупинитися на електроном будові вільних атомів.
Ядро і електронна оболонка атома
Кожен атом складається з ядра та електронної оболонки (рис.1). Електронна оболонка атома - це сукупність елементарних частинок - електронів, кожному з яких властивий корпускулярно-хвильової характер.
Електрон як частка має масу спокою. Me = 9,1095 · 10ˉ 31 кг і несе негативний електричний заряд, рівний 1,6022 · 10ˉ 19 Кл. Абсолютна (без урахування знака) значення цього заряду є найменшим і називається елементарним зарядом.
Атом в цілому не заряджений (електрично нейтральний). Це обумовлено тим, що сума негативних зарядів електронів компенсована позитивним зарядом ядра атома: в кожному атомі число елементарних негативних зарядів в оболонці дорівнює числу елементарних позитивних зарядів в ядрі.
Між позитивно зарядженим ядром атома і негативно зарядженими електронами його оболонки діють електростатичні (кулонівських) сили тяжіння. Геометричний розмір атома, умовно записується діаметром його електронної оболонки, має порядок 10ˉ 10 м, а діаметр атомного ядра - порядок 10ˉ 14 м, тобто за розміром ядро в 10000 менше, ніж атом. Звідси слідує що:
маса атома зосереджена в його ядрі.
У найлегшій атомі водню (мається на увазі атом одного з ізотопів водню - протію, ядро якого складається з одного протона) ядро має масу 1,6726 · 10ˉ 27 кг; електрон легше ядра в 1836 разів (фактично мова йде про порівняння мас електрона і протона).
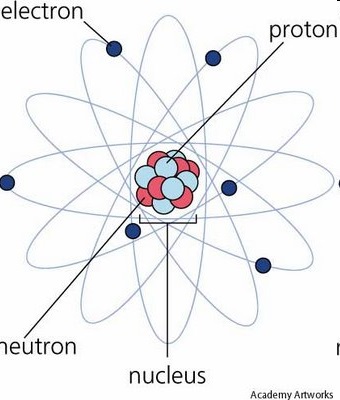
Мал. 1 Ядро і електронна оболонка