
Губка Discodermia dissolute
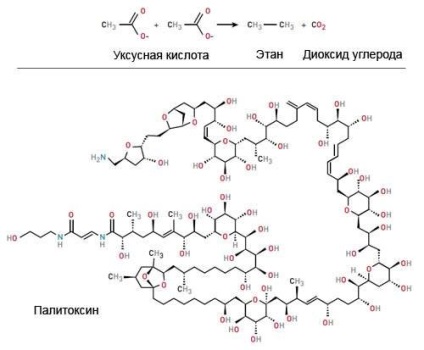
Органічна хімія зародилася в середині XIX в. Однією з перших реакцій стало отримання Адольфом Кольбе етану з оцтової кислоти. Сьогодні хіміки можуть синтезувати навіть таких монстрів, як палітоксін
Завдяки роботам цьогорічних лауреатів діскодермолід вдалося синтезувати в лабораторії - і, можливо, скоро одним засобом боротьби з раком у нас буде більше
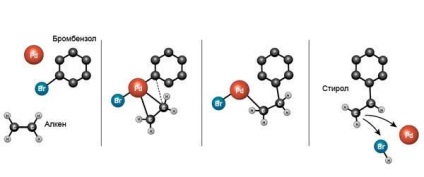
Річард Хек експериментував з використанням паладію в якості каталізатора реакцій органічного синтезу і вперше зумів, в тому числі, отримати стирол за допомогою такого перетворення
Сучасної цивілізації, її промисловості і технологій потрібні все більш і більш складні хімічні сполуки зі все більш рідкісними властивостями. Пацієнтам потрібні ліки, які лікують тяжкі недуги. Електронної промисловості - матеріали, що випускають світло. Сільському господарству - інсектициди нового покоління.
Хімікам нудьгувати не доводиться: на всі запити потрібно відповісти, шукаючи способи синтезувати найвитонченіші молекули. У цій області працює ціла армія фахівців, перш за все, в області синтетичної органічної хімії, і вся ця армія з вдячністю ставиться до нинішніх Нобелівським лауреатам, знахідки яких зробили їх роботу і простіше, і ефективніше.
Почалося все абсолютно несподівано. В кінці 1980-х аквалангісти в Карибському морі, на глибині 33 м, займалися збором цікавого організму, губки Discodermia dissolute. Ці невеликі і дивні створіння позбавлені очей і рота, шлунку і кісток. Вони не здатні пересуватися здаються примітивними, але всі ці недоліки вони з лихвою заповнюють майстерністю в області синтетичної хімії. Губки відрізняються здатністю отримувати великі і складні молекули, які не використовують ніякі інші живі істоти. Ці сполуки допомагають їм захищатися від ворогів, як ефективні репеленти і отрути. Вони ж і залучають вчених, які, витягуючи з губок подібні речовини, на їх основі створюють нові антибіотики, противірусні та протизапальні сполуки.
В даному ж випадку першим речовиною, яке вдалося виділити з Discodermia dissolute. став діскодермолід. який сьогодні вважається досить перспективним засобом хіміотерапії: крім іншого, це з'єднання в ході лабораторних тестів показало здатність блокувати ріст культури пухлинних клітин.
Вчені зайнялися дослідженнями діскодермоліда пильніше і показали, чим саме пояснюються ці його цитостатические властивості. Виявилося, що діє він приблизно так, як уже відоме паклітаксел. яке під найменуванням Taxol широко використовується в онкології - тобто, порушуючи роботу цитоскелета і пригнічуючи процес поділу клітини. На цьому історія могла б і закінчитися: діскодермолід пройшов би багатоступінчастий процес клінічних випробувань і під яким-небудь помітною назвою вчинив би в аптеки. Але на цьому шляху стала одна проблема.
Діскодермолід виявився надзвичайно складним за структурою органічною сполукою, а добувати його в промислових масштабах з бідної губки - завданням малореальною. Знадобилося знайти спосіб синтезувати його штучно. На щастя, такий спосіб був знайдений дуже швидко - завдяки роботам хіміків Річарда Хека (Richard Heck), Еічі Негиши (Ei-ichi Negishi) і Акіри Судзукі (Akira Suzuki), які досліджували можливості використання паладію як каталізатора реакцій крос-поєднання.
Це досить широкий клас органічних реакцій, що складається в з'єднанні вуглеводневих радикалів через «посередництво» металу. Це може бути поєднання двох різних вуглеводнів з утворенням нового, або двох однакових з формуванням димерной молекули. Варіантами крос-поєднань є і запропоновані новоспеченими лауреатами реакція Хека. реакція Негиши і реакція Судзукі. Для штучного отримання діскодермоліда центральної стала реакція Негиши, яку після деякої оптимізації вдалося довести до розуму - і приступити до клінічних випробувань майбутнього протипухлинного препарату.
Зрозуміло, що історія з діскодермолідом - лише приклад того, які наслідки мали наукові дослідження хіміків, пов'язані з використанням паладієвих каталізаторів в органічному синтезі. Про важливість цієї області для науки і для всього людства може говорити хоча б той факт, що за роботи з органічного синтезу Нобелівська премія вручається вже в шостий раз.
Крос-поєднання з паладієвих каталізаторів виявилися особливо ефективним інструментом синтезу в тому числі і тому, що проходять ці реакції в порівняно м'яких умовах, не вимагаючи екстремальних температур і інших впливів. Якщо без них для того, щоб з'єднати два ланцюжки вуглеводнів, потрібна, скажімо, обробка високоактивними реагентами, що діють без розбору і призводять до утворення цілої маси побічних продуктів, ця реакція високо вибіркова і майже ювелірна.
Атоми паладію виступають, як «місце зустрічі» окремих вуглеводневих ланцюжків, які більша прірва між ними на досить близькій відстані для того, щоб між ними пройшла реакція синтезу. Після чого паладій вивільняється - і може знову брати участь у новій реакції.
Про подібні здібності паладію заговорили ще в 1950-х, тоді ж німецька хімічна компанія Wacker Chemie AG з успіхом стала використовувати його у виробництві, в якості каталізатора синтезу ацетальдегіду з етилену (ацетальдегід застосовують для отримання барвників, пластмас і цілого ряду органічних сполук, в тому числі оцтової кислоти). У ті роки Річард Хек працював у хімічній промисловості, але по інший бік океану, в США. Його компанія, як і багато інших, була кровно зацікавлена в тому, як працює процес німецьких конкурентів, і не існує способу ще більш ефективного.
Щоб зрозуміти всю важливість роботи Хека, давайте згадаємо основи хімії. Атом будь-якого елементу являє собою надзвичайно малу за обсягом позитивно заряджене ядро, яке оточують негативно заряджені електрони. Електрони приймають відповідні енергетичні стану, умовно названі атомними орбиталями. У міру збільшення маси і розмірів атома зростає число електронів в ньому, які, повністю заповнивши одну орбіталь. переходять до наступної, більш енергетичної.
З точки зору хімії найбільший інтерес представляє лише найостанніша орбиталь, оскільки саме нею визначається то, в які реакції вступає елемент. Ті, у кого зовнішня орбиталь заповнена електронами лише трохи не до кінця, прагнуть завершити це заповнення і відбирають електрони у сусідів, проявляючи окисні властивості неметалів. І навпаки, якщо зовнішня орбиталь лише почала заповнюватися і простіше віддати 1-2 електрона, ніж набирати нові, то атом виявляє відновні властивості і бере участь в реакції, як активний метал.
Реакції органічних речовин багато в чому визначаються властивостями головних їх компонентів - вуглецю, кисню та азоту. Їх зовнішня оболонка «прагне» до повного заповнення до 8-ми електронів.
Сам по собі вуглець має лише 4 електрона на зовнішній орбіталі і прагне до утворення ковалентних зв'язків, в яких зміг би або віддати їх, або отримати додаткові 4. Наприклад, в найпростішому органічному поєднанні, метані. один атом вуглецю сполучений з 4-ма атомами водню, «розділяючи» електрони з ними і повністю заповнюючи свою зовнішню орбиталь. Атом «повністю задоволений».
Коли хімік використовує той же метан для синтезу інших з'єднань, йому доводиться шукати спосіб перехитрити цей «повністю задоволений» атом, перекинути його через енергетичний бар'єр з тим, щоб він «шукав спосіб» по # 8209; іншому розібратися зі своєю зовнішньою орбиталью. Для подолання бар'єру можна використовувати різні способи - наприклад, впливати ультрафіолетом, високою температурою або навіть електричними розрядами (або всіма ними одночасно). Але такий лобовий підхід застосуємо в лабораторії, але не в промисловості, де він вимагає величезних витрат.
Тому ще в 1912 р Нобелівський комітет вшанував заслуги французького хіміка Віктора Гриньяра. який вперше знайшов елегантний спосіб «обдурити» вуглець і змусити його вступати в реакцію - використовувати металевий каталізатор, магній. Маючи на зовнішньої орбіталі лише 2 електрони, магній легко віддає їх вуглецю і виступає вельми привабливим партнером по реакції.
Якщо брати приклад того ж метану, то замість того, щоб ділити атоми з воднем, вуглець може відтягнути на себе пару електронів магнію, в общем-то, майже повністю забравши їх собі. Але це дійсно хитрий трюк: атом вуглецю стає іоном, оскільки виникає дисбаланс між позитивно зарядженим ядром і електронною оболонкою, яка отримує перевагу в два очки. Цей дисбаланс робить атом «агресивним», він, як кажуть хіміки, атакує інші атоми вуглецю і утворює з ними ковалентний зв'язок.
Реакція Гриньяра стала найважливішим інструментом органічної хімії та хімічної промисловості. З нею вчені і технологи зуміли синтезувати масу органічних сполук. Однак коли справа дійшла до особливо великих і складних з'єднань, використання реактивів Гриньяра, утворених магнієм і органічною речовиною, зіткнулося з низкою складнощів. Коли перед описаним вище «обдуреним і агресивним» вуглецем встає цілий ряд можливостей, який з інших вуглеців атакувати, він довго не роздумує і приймається за будь-, який опинився досить близько. В результаті утворюється величезна кількість самих різних і безглуздих з'єднань, а вихід шуканого виявляється занадто низьким.
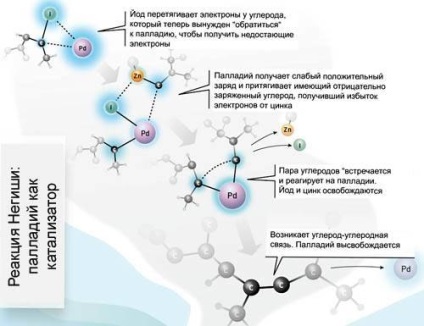
Цю проблему і вирішує використання більш ефективного каталізатора - паладію, основу чого поклав Річард Хек. У 1977 р відштовхуючись від робіт Хека, Еічі Негиши створив свого роду варіант реактивів Гриньяра, в яких замість магнію використовувався цинк. Це саме по собі не робить вуглець більш активним, але тут в справу вступає другий учасник реакції, інший органічний радикал, з'єднаний з йодом і паладієм. Взаємодіючи цими групами, вони орієнтуються таким чином, що пара вуглеців «зустрічається» у паладію досить близько, щоб між ними моментально пройшла реакція (див. Ілюстрацію зліва).
А парою років Акіра Судзукі замінив цинк на більш м'який і менш токсичний бор. Це дозволило значно ширше і простіше використовувати технологію в промисловості. Сьогодні за допомогою реакції Судзукі синтезуються тисячі тонн різних з'єднань, наприклад, фунгіцидів для сільського господарства. Застосовуючи ці методи вдалося синтезувати навіть справжнього динозавра органічної хімії, отруйну молекулу палітоксіна. що включає 129 атомів вуглецю, 223 водню, 3 азоту і 54 кисню.