Оскільки генна мутація в порівнянні з хромосомною стосується невеликої частини генетичного матеріалу, то її носій найчастіше зберігає репродуктивну функцію. Тому молекулярно-генетичні хвороби можуть передаватися в поколіннях і є спадковими.
Спадкова хвороба - це хвороба, зумовлена мутацією (частіше генної) в статевій клітині, яка може передаватися в поколіннях.
Терміни, які означають таку патологію, зазвичай мають закінчення -патія. ферментопатия, гемоглобінопатії, мембранопатія, тромбоцитопатія і т. п.
У носія, який отримав генну мутацію в спадок, розвивається ланцюг молекулярних, клітинних і системних порушень, які представляють патогенез спадкової хвороби.
Порушення на молекулярному (біохімічному) рівні. Мутація структурного гена призводить до порушення структури білкової молекули, т. Е. Послідовності амінокислот в поліпептидних ланцюгах білка без зміни його кількості. Мутація регуляторного гена спричинює змін кількості білка без зміни його структури.
Біохімічні наслідки мутації залежать від функції того білка, синтез якого порушений.
Якщо це ферментопатия (ензимопатія). то порушення активності навіть одного ферменту може клінічно проявитися недоумством, хворобами системи крові, ендокринної та інших систем. Ферментопатії лежать в основі багатьох хвороб, але для їх діагностики завжди необхідно біохімічне підтвердження. Так, якщо синтез ферменту повністю відсутня, то за допомогою імунологічних методів цей білок (фермент) не виявляють. Може порушуватися швидкість синтезу ферменту, і тоді зменшиться його кількість. Оскільки синтез білкової молекули переважно кодується не одним, а кількома генами, то порушення структури певного ферменту частіше детерміновано мутацією різних генів.
Результатом порушення структури молекули ферменту можуть бути зниження її стабільності, протеоліз і руйнування зміненого мутацією ферменту.
Каталітична активність ферменту може бути зниженою або бути відсутнім навіть при нормальному його кількості. Це буває результатом відсутності активаторів або надлишку інгібіторів ферменту, відсутність рецепторів до нього, порушення топографії розподілу ферменту в клітині, структури його каталітичного центру. В останньому випадку, якщо пошкоджена ділянка ферменту, призначений для його взаємодії з іншими молекулами, то порушується впізнавання ферменту або його спорідненість до субстрату.
У гомозиготного носія мутантного рецесивного гена активність ферменту різко знижена, іноді повністю відсутня, у гетерозиготного - активність знижується в меншій мірі. В останньому випадку ферментопатия визначається тільки під час навантаження харчовими, виробничими факторами, факторами навколишнього середовища або лікарськими засобами та проявляється як спадкова схильність до хвороби (див. Нижче).
Також можливе підвищення активності ферменту (в разі пригнічення ингибиции), і тоді може відбуватися неконтрольований синтез кінцевих продуктів (наприклад, при подагрі).
Крім залежності клінічних проявів ензімопатії від зниження або підвищення активності ферменту важливе значення має приналежність ензімопатії до метаболічних шляхах: анаболізму або катаболізму.
У разі підвищення активності ферментів анаболізму стимулюється синтез кінцевих продуктів. І навпаки, при блокуванні анаболічних шляхів порушується білоксинтезуючої процес, що обумовлює дефіцит кінцевого продукту і накопичення субстрату-попередника (так, дефіцит глікогенсинтетазу в печінці викликає зниження рівня глікогену в печінці і накопичення глюкози в крові).
Якщо взяти до уваги, що в організмі людини міститься близько 10 тис. Ферментів, то 200 ферментопатий, які вже описані, складають всього 2%. Це означає, що наші знання про спадкові порушення метаболізму недостатні. Краще вивчені дефекти катаболічних шляхів, ніж анаболічних. Можливо, дефіцит ферментів основних анаболічних шляхів обумовлює передчасну смерть.
Патогенетичною основою "мітохондріальних" хвороб є порушення в системі окисного фосфорилювання.
До актуальних аспектів зазначеної проблеми відносяться порушення ферментної системи репарації пошкодженої ДНК, що зумовлюють чутливість організму до мутагенів. Доведено, що патологія саме цієї ферментної системи - важлива ланка патогенезу злоякісного росту і передчасного старіння. До даної патології належить синдром спонтанної хромосомної нестабільності, який проявляється грубими хромосомними абераціями і добре вивчений в препаратах метафазних пластинок культури лімфоцитів пацієнтів. І хоча ці порушення реєструються при вивченні культури клітин пацієнта в разі їх фітогемагглютініновой стимуляції in vitro, вважається, що нестійкість хромосом спостерігається in vivo. Такий хворий більш схильний до раку.
В контексті даної теми слід зазначити, що метаболізм більшості чужорідних речовин, що надходять в організм (продуктів харчування, лікарських препаратів і т. Д.), Знаходиться під генетичним контролем активності ферментів. Розщеплення і перетворення цих речовин в організмі може бути аномальним з утворенням токсичних проміжних продуктів (така непереносимість речовин іноді помилково розглядається як алергія, але в основі лежать не імунні механізми, а ферментопатии). Дану групу порушень вивчає екогенетики. Особливо це актуально в відношенні лікарських препаратів, період напіврозпаду яких в організмі також визначається генетичними факторами і у 2,5% населення він втричі менше середнього значення. Період напіврозпаду настільки індивідуальний, що у відповідь на однакову дозу лікарського препарату у одних пацієнтів терапевтичний ефект може не проявлятися, у інших осіб виникають побічні дії і розвиваються токсичні ускладнення (фенацетин викликає метгемоглобінемію, каптоприл - агранулоцитоз). Всі ці проблеми визначили виникнення окремого наукового напрямку - фармакогенетики.
Гемоглобінопатія - результат мутації гена, відповідального за синтез гемоглобіну, коагулопатія - генетично детермінований дефіцит факторів гемостазу, імунодефіцити - генетично детерміновані порушення імунної відповіді, мембранопатія - генетичний дефект білкових молекул клітинних мембран (наприклад, моногенна гіперхолестеринемія, що виникає внаслідок порушення роботи рецепторів ліпопротеїдів з низькою щільністю ; муковісцидоз, при якому порушено утворення трансмембранного регулятора хлорних каналів, регульо чих транспорт іонів хлору через апікальні мембрани епітеліальних клітин).
Вітамінзавісімих спадкові хвороби - генетично обумовлені порушення обміну того чи іншого вітаміну. Так, у разі порушення обміну тіаміну, піридоксину, ціанокобаламіну (вітамін B12), біотину (вітамін Н), фолієвої кислоти (вітамін B9) виникають порушення функцій нервової системи, при дефіциті кальциферол (вітамін D) - кісткової тканини; недолік філохінон (вітаміни групи К), ціанокобаламіну призводить до патології крові; при авітамінозах А і E виникають мембранопатіі.
Можливий генетично детермінований дефіцит транспортних білків (при дефіциті трансферину - переносника заліза - розвивається залізодефіцитна анемія), а також молекул пептидних гормонів (наприклад, гіпотиреоз як результат недостатнього синтезу гормонів щитовидної залози).
Порушення на клітинному рівні при спадкових хворобах проявляються зміною форми і функцій клітини. Прикладом можуть бути серпо-, сферо- і мішеневідние еритроцити, які утворюються при спадкової анемії. Тромбоцитопатія - це порушення функції тромбоцитів без зміни їх кількості. Описано спадкові дефекти різних частин клітин і органел - мембран (дефіцит спектрина в мембрані еритроцитів викликає порушення її еластичності і перетворення еритроцитів в мікросфероціти при микросфероцитарной гемолітичної анемії), специфічних гранул (у нейтрофілів), внутрішньоклітинних месенджерів (при псевдогіпопаратиреоз), рецепторів (рецепторні хвороби, наприклад, моногенна гіперхолестеринемія, що виникає внаслідок патології рецепторів ендотелію судин для ліпопротеїдів низької щільності, в результаті чого н арушается клітинний ендоцитоз і не досягається нормальна швидкість виведення холестерину з крові).
Порушення на рівні всього організму (т. Е. Фенотипічні прояви мутації) залежать від характеру метаболічних порушень, а також типи клітин, структура і функція яких порушені.
Грубі генетичні аномалії настільки сильно змінюють фенотип, що репродуктивна здатність носіїв генетичної аномалії знижується або зникає. Загибель носія може статися внутрішньоутробно (що призведе до мимовільного викидня), а загибель зигот до настання їх імплантації найчастіше відбувається непомітно. Більшість ембріонів з трисомиями по 13-й і 18-й парам хромосом гинуть на ранніх стадіях розвитку. Якщо ж мутація сумісна з постнатальним існуванням, розвиваються хвороби як у носія генетичної аномалії, так і у його потомства при збереженні репродуктивної функції.
На популяційному рівні мутантні гени накопичуються (генетичний вантаж популяції), якщо хворі зі спадковими хворобами виживають і відтворюють потомство. Це стосується в основному молекулярно-генних скелетних і стоматологічних аномалій, а також розумової відсталості. Вважається, що майже кожна людина є гетерозиготних за кількома генами, летальним в гомозиготному стані гена. У популяції виникають нові шкідливі мутації під впливом іонізуючого випромінювання, інших мутагенних чинників навколишнього середовища. Теоретично існує критичний рівень генетичного вантажу як механізм виродження популяції. Велику роль в накопиченні мутантних генів грає кровну спорідненість батьків (у них підвищена вірогідність наявності однакових рецесивних патологічних генів в гетерозиготному стані). Деякі спадкові хвороби описані тільки в популяціях невеликого розміру (изолятах).
Розвиток спадкових хвороб залежить від типу успадкування, т. Е. Має значення, який вид гена (домінантний або рецесивний) піддався мутації, чи є мутація 23-й пари (статевих) хромосом, одним або групою генів детермінована патологія.
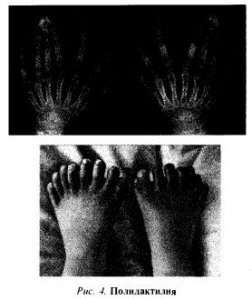
Хвороби з домінантним типом успадкування. Мутація домінантних генів проявляється як в гомо-, так і в гетерозиготному стані. Виживають і успадковують патологію носії тих домінантних генів мутантів, які суттєво не порушують життєздатність, не перешкоджають розмноженню, а отже, мало підпадають під природний відбір. Домінантні генні мутації призводять до добре відомим фенотипам. Це найчастіше скелетні аномалії: багатопалості (рис. 4), короткопалость, зрощення або викривлення пальців, аномалії зубів (наприклад, відсутність бічних різців), а також далекозорість, короткозорість, астигматизм, отосклероз, ахондроплазия (карликовий ріст і непропорційне будова тіла).
За аутосомно-домінантним типом успадковуються вроджена катаракта, полікістоз нирки, деякі форми м'язової атрофії, прогресуюча хорея Гентингтона (дегенеративні зміни нервових клітин в базальних гангліях), множинний поліпоз товстої кишки (має тенденцію до малігнізації), нейрофіброматоз (хвороба Реклінгхаузена). Більшість цих важких хвороб є результатом мутації de novo у батьків, у яких дана патологія відсутня. Моногенні хвороби з частковим (неповним) домінуванням визначаються у гомо- і гетерозигот, але найбільш важко протікають у гомозигот.
Хвороби з рецесивним типом успадкування. Якщо мутантний ген є рецесивним, то хвороба розвивається лише в гомозиготному стані гена, т. Е. В тому випадку, якщо дитина отримує патологічний ген від обох батьків, які, будучи гетерозиготними носіями ознаки, залишаються здоровими. Так успадковуються ферментопатии. До цієї ж групи хвороб відносяться вроджена глухонімота, пігментний ретиніт, мікроцефалія.
Хвороби, зчеплені зі статевою хромосомою. Розвиток захворювання у носіїв мутантних генів в X- або Y-хромосомі залежить від статі пацієнта. Мутація в Y-хромосомі передається по чоловічій лінії незалежно від того, домінантний ген або рецесивний. Якщо мутація відбулася в гені, локалізованому в Х-хромосомі, то має значення, домінантний він або рецесивний. Якщо він домінантний (наприклад, ген гіпофосфатемічному рахіту, який не піддається лікуванню вітаміном D2), то виявляється патологією як у чоловіків, так і у жінок в гетерозиготному стані гена. Якщо він рецесивний (при гемофілії А, дальтонізмі, юнацької глаукомі, гемералопії - відсутності сутінкового зору), то захворіти можуть тільки чоловіки, так як мають одну Х-хромосому. Оскільки жінки є носіями двох Х-хромосом, то при гетерозиготному стані мутантного гена вони залишаються здоровими і разом з тим передають цей ген дітям чоловічої статі (жінки можуть захворіти лише в разі гомозиготного стану мутантного гена, що буває рідко).
"Мітохондріальні" хвороби, пов'язані з мутацією мітохондріальної ДНК, зустрічаються тільки у жінок, хоча дана патологія не має відношення до ядерних Х-хромосомами. Справа в тому, що зигота отримує мітохондрії від яйцеклітини. Це і визначає материнський тип успадкування.
Хвороби з полігенним типом успадкування. Оскільки більшість ознак в організмі детерміновані не одним, а кількома генами, серед яких можуть бути домінантні і рецесивні, аутосомні і зчеплені з підлогою, то це обумовлює розвиток хвороб з полігенним типом успадкування. Для деяких хвороб такі гени точно визначені (так, розвиток подагри детермінується двома генами, розташованими в Х-хромосомі, схильність до алкоголізму детермінована генами ферменту алкогольдегідрогенази і опадів).