система "рідина - пористе середовище"
Щоб детально розібратися з процесами фізико-хімічної взаємодії дисперсних систем і дисперсного середовища розглянемо більш докладно структури води.
Молекула води, як відомо, представлена двома одновалентними іонами водню і одним двовалентним іоном кисню. Молекула води не є енергетично нейтральної. Це пояснюється тим, що атоми водню приєднуються до кисню з однієї і тієї ж боку, що і викликає виникнення електричного моменту. За іншими даними іони водню і кисню в молекулі води розташовані в вершинах рівнобедреного трикутника, причому кут біля вершини трикутника, зайнятий іоном кисню дорівнює 105 °.
Дипольна молекул води обумовлює їх здатність вступати один з одним в зв'язок, притягаючи полюсами протилежного знака. Це призводить до того, що структура води має як би пухке будова. Її істинний обсяг перевищує розрахункові значення.
Пояснити відсутність електронейтральності молекули води можна і в такий спосіб. Атом водню, який має одну стабільну орбіту, здатний утворювати лише одну ковалентний зв'язок. Однак, незважаючи на це виявляється, що в деяких випадках атом водню може прийняти до себе і тим самим зв'язати між собою два атома. В цьому випадку виникає вже іонна зв'язок, тобто зв'язок, в основі якої лежить кулоновское тяжіння між різнойменно зарядженими тілами. Така воднева зв'язок більш вірогідна ніж більш електронегативний атоми, що з'єднуються воднем. Іон кисню має високий негативний заряд і тому він легко утворює водневі зв'язки з іонами водню. Внаслідок цього ж молекули води можуть легко асоціюватися між собою в комплекси. При цьому структура води змінюється. Її зміна можлива і у поверхні твердої фази.
Наявність електричного поля у молекули води обумовлює і надзвичайну її розчиняють здатність, тому що сили взаємодії між зарядженими частинками в воді зменшуються в 81 разів. В результаті цього міцність всередині молекулярної зв'язку стає недостатньою і частинки під дією броунівського руху переходять в розчин.
Диполі можуть притягатися іонами внаслідок взаємного тяжіння електричних зарядів, властивих, з одного боку йону а, з іншого - полісами молекул води. Це явище називається гідратацією іонів і виражається в освіті гідратної оболонки навколо іонів, що складається з притягнутих іонів молекул води. З огляду на різний розмір іонів, можна заздалегідь передбачити, що величина цих гідратних оболонок буде у різних іонів різної.
В даний час структура твердих тіл в основному досить таки детально вивчена. В її основу покладено моделі типу жорстких кульок, кульок з притяганням і пружних кульок. Як наслідок цього існують кількісні теорії рідин типу ідеальних газів, частково рідких металів і деяких молекулярних рідин. Для асоційованих рідин з водневими зв'язками задовільною теорії в даний час немає.
У літературі структура електронної хмари в основному описується тетраедричних моделлю, з атомом кисню в центрі і атомами водню в двох вершинах і двома негативними зарядами, що символізують відокремлені електронні пари в двох інших вершинах тетраедра.
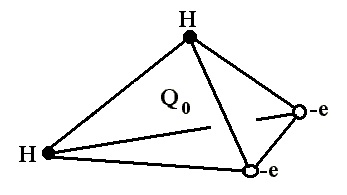
Тому молекула води може брати участь в чотирьох водневих зв'язках: в двох за рахунок протонів і в двох за рахунок неподіленого пар атома кисню. Особливості поведінки води обумовлені і орієнтацією ядерних спінів двох протонів. Найбільш поширені такі структурні моделі води: кластерна, клатратного і континуальної (безперервна).
У кластерної моделі (Ж. Немет, Н. Шерега) модель води представлена у вигляді кластерів, тобто в певній зоні молекул пов'язані між собою в інший зв'язку немає. При цьому є можливість розпаду кластерів, появленье нових.
Клатратного модель (Самойлов С. Я.) передбачає утворення сітки водневих зв'язків між молекулами води, всередині якої є порожнечі, що заповнюються мономірними молекулами (не мають водневих зв'язків).
Континуальна модель (І. поплив) передбачає відсутність молекул води з розірваними водневими зв'язками, що утворюють кільцеві асоціати.
Складна структура води обумовлює і її специфічні властивості, а також їх залежності від температури.
Ось деякі з них:
Питома поверхня колекторів нафти і газу нерідко досягає тисяч м 2. Тому між фільтром рідиною і колектором існує на кордонах розділу поверхневе взаємодія. Ця взаємодія має суттєвий вплив на фільтрацію.
Найважливішим характеристикою поверхні розділу фаз є поверхневий натяг. Відомо, що поверхневий натяг на межі рідина-газ залежить від багатьох факторів - хімічного складу рідини і газу, температури, тиску та ін. Факторів. Зі збільшенням температури і тиску поверхневий натяг зменшується. Складніше характер зміни поверхневого натягу на межі нафта-рідина. Якщо нафта дегазувати і майже не містить полярних компонентів, її поверхневий натяг на межі з водою практично не залежить від температури і тиску. Якщо ж в нафті містяться полярні компоненти, розчинні у воді, то з ростом тиску і температури поверхневий натяг її на кордоні з водою може збільшуватися. При наявності розчинних газів залежність ускладнюється.
Безпосередньо виміряти поверхневий натяг на поверхні твердого тіла важко. В цьому випадку поверхневий натяг оцінюється побічно - шляхом зміни крайового кута змочування, який також служить і мірою змочування рідиною поверхні твердого тіла. Поверхня твердого тіла змочується тим краще, чим менше різниця полярностей між тілом і рідиною. Високополярние рідини, тобто володіють високим поверхневий натяг, змочує тверду поверхню гірше, ніж малополярние. Наприклад, ртуть змочує лише деякі метали, тоді як менш полярна рідина - вода змочує не тільки метали, а й багато мінералів, а мало полярні масла - всі тверді тіла.
Величина кута змочування залежить від багатьох факторів. Особливо великий вплив на неї надає процеси адсорбції. Наприклад, обробкою ПАР можна значно збільшити смачиваемость і навпаки зменшити.
У період розкриття продуктивного пласта і в період освоєння кордону розділу фаз не залишаються стабільними: при розтині - нафта відтісняється від свердловини, при освоєнні навпаки. При такій зміні напрямку руху змінюється і кут змочуваності.