У періодичній таблиці хімічних елементів натрій Na розташований в третьому періоді I групи головної підгрупи.
Розповідаючи про будову атома натрію, учень повинен зображені зить розподіл електронів по електронним верствам:
Однак за бажанням учень може розширити свою відповідь інформацією про склад атома графічною схемою і електронної формулою:
Натрій - метал. Основна ступінь окислення +1. Натрій утворює оксид Na2O і гідроксид NaOH, які виявляють основні властивості.
При висвітленні питання про знаходження натрію і його сполук в природі необхідно відзначити, що як проста речовина натрій в природі не зустрічається через високу хімічну активність. Отримують натрій з розплаву хлориду або гідроксиду натрію при проходженні через нього електричного струму.
Натрій - сріблясто-білий метал, з невеликою щільністю, легкоплавкий, легко окислюється на повітрі.
При характеристиці хімічних властивостей необхідно відзначити, що натрій, як і інші лужні метали, надзвичайно активний метал. Це відбувається тому, що він легко віддає єдиний електрон, що знаходиться на зовнішньому електронному шарі.
Далі можна розглянути його взаємодію: а) з простими речовинами; б) зі складними речовинами.
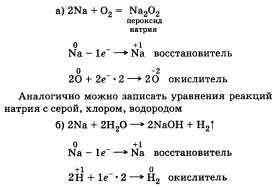
При записи рівнянь реакцій зі складними речовинами необхідно пам'ятати, що в розчинах кислот натрій спочатку реагує з водою (див. Реакцію вище), а потім вже йде реакція між лугом і кислотою:
Закінчити відповідь можна розповіддю про застосування натрію.
Застосування натрію як металу пов'язане з його відновні властивості; він використовується в якості каталізатора в органічній хімії, газу-наповнювача в світильниках, у вигляді сплаву з калієм - як холодоагент в ядерних реакторах на швидких нейтронах. Світове щорічне споживання натрію і його сполук перевищує 100 млн т.
Найбільш важливі сполуки натрію, що застосовуються в побуті та на виробництві, - бікарбонат натрію NaHCO3, карбонат натрію Na2CO3, гідроксид натрію NaOH, розчин силікату натрію Na2SiO3 (рідке скло) - силікатний клей.