ортофосфати, пірофосфати (діфос-фати) і конденсується. фосфати натрію. Кристалічні. або стеклообразниє в-ва, добре розчин. в воді, утворюють кристалогідрати (див. табл. 1,2). Про р т о ф о з ф а т Na3 PO4. д и р і д р про про р т о ф о з ф а т NaH2 PO4 і г і д р про про р т о ф о з ф а т Na2 HPO4 отримують взаємодій. Н 3 РО 4 з Na2 CO3 або NaOH з послід. кристалізацією солей і висушуванням їх до безводних солей або кристаллогидратов NaH2 PO4. H2 O, Na2 HPO4. 12H2 O і Na3 PO4. 12H2 O. Останній отримують також нагріванням АlРО 4 з Na2 CO3 при 900 o С з послід. вилуговуванням водою і кристалізацією з розчину.
П і р про ф про з ф а т Na4 P2 O7 поліморфа; трігідро-NaH3 P2 O7. дигідро-Nа 2 Н 2 Р 2 О 7 і гідропірофосфати Na3 HP2 O7 розкладаються вище 250 о С з утворенням конденсованих Н. ф. Отримують нейтралізацією Н 4 Р 2 О 7 лугом, дегідратацією гідроортофосфат Na, Na3 HP2 O7 x х 9Н 2 О-подкислением розчину Na4 P2 O7 соляної к-тій.
Табл.1.-властивості орто- і пірофосфат натрію
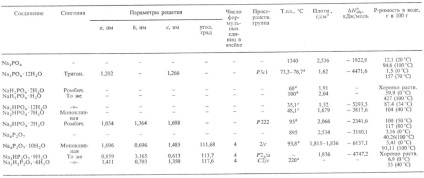
a З втратою води, повне зневоднення при 100 ° С.Б> Повний зневоднення при 95 ° С. до Повного обезвожіваніе.г З> втратою 5 молекул води. д Втрачає 1 молекулу води, неплавясь.
Табл. 2.-ХАРАКТЕРИСТИКА КОНДЕНСОВАНИХ ФОСФАТІВ НАТРІЮ
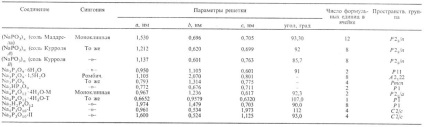
К о н д е н с і р про в а н н и е Н. ф. (Устар. Назв.-метафосфати натрію) містять угруповання (РО 3) -. Поліфосфати мають лінійне цепочечную будова, ціклофос-фати (NaPO3) n. де п = 3,4,12-циклічне.
Тетраціклофосфат Na4 P4 O12 може мати конформацшо крісла або ванни. Безвода сіль відома тільки в конфор-ції ванни. Тетраціклофосфат Na отримують при нагр. еквімолярних кол-в NaH2 PO4 і Н 3 РО 4 при 400 ° С з послід. повільним охолодженням плаву. Одержаний Na2 H2 P4 O12 нейтралізують розчином NaOH. Др. спосіб полягає в нейтралізації розчину Н 4 Р 4 Про 12 лугом до рН 7 при охолодженні.
Олігомерного трифосфат Na5 P3 O10. має лінійне цепочечную будова, існує в двох модифікаціях, т-ра переходу II I 417 ° С. Утворюється при плавленні суміші солі Грема з Na4 P2 O7 з послід. повільним охолодженням, дегідратацією суміші Na2 HPO4 і NaH2 PO4 при 350-400 ° С (форма II) або при 500-550 ° С (I). Кількість трифосфата становить 70% від всіх випущених в пром-сті лужних фосфатів.
Н. ф. застосовують як компоненти миючих ср-в, як пом'якшувачі води, детергенти для очищення металів, ПАР в произове цементів і при бурінні нафтових свердловин. Особливо хорошим миючим ефектом володіють синтетичні. миючі ср-ва з добавкою трифосфата Na (10-50%). Для усунення жорсткості води використовують зневоднені Н. ф. утворюють комплекси з Mg, Ca, Ва і ін. металами. Н. ф. застосовують при збагаченні руд, в произове фосфатних стекол, фарб і ін. в якості добавок або вихідної сировини, як тeкстільно-допоміжні. в-ва, в харч. пром-сті (розпушувачі тесту, для гомогенізації і поліпшення консистенції сирів, ковбас, згущеного молока), в фотографії (компоненти проявника), в електролітич. процесах і ін.
Літ .: Корбрідж Д. Фосфор. Основи хімії, біохімії, технології, пров. з англ. М. 1982; Comprehensive inorganic chemistry, ed. by J.C. Bailar, A. F. Trot-man-Dickenson, v. 1, Oxf. 1973. Л. H. Коміссарова, П. П. Мельников.
Хімічна енциклопедія. - М. Радянська енциклопедія. Під ред. І. Л. Кнунянц. 1988.