Окислювально-відновні реакції - реакції, що протікають зі зміною ступеня окислення елементів.
Окислення - процес віддачі електронів атомом
Відновлення - процес прийому електронів атомом
Восстановитель - елемент, який чи електрони
Окислювач - елемент, який бере електрони
Для наочного, але спрощеного уявлення про причини зміни зарядів у елементів звернемося до малюнків:
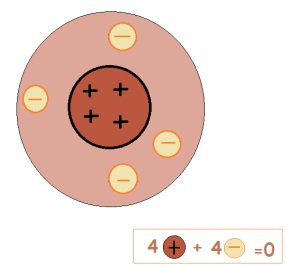
Атом-це електронейтральна частинка. Тому число протонів дорівнює числу електронів
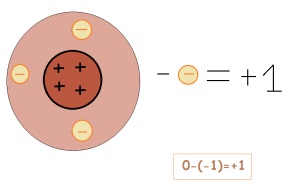
Якщо елемент віддає електрон, то його заряд змінюється. Він стає позитивно зарядженим (якщо приймає, навпаки, негативно)
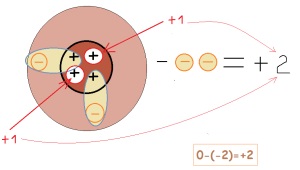
Т.ч. на заряд елемента впливає кількість відданих або прийнятих електронів
I. Складання рівнянь окисно-восставновітельних реакцій
1. Записуємо схему реакції
Na + Cl2 -> NaCl
2. Розставляємо ступеня окислення елементів:
Na 0 + Cl2 0 -> Na + Cl -
3. Виписуємо елементи, що змінили ступінь окислення і визначаємо число відданих / прийнятих електронів:
4. Знаходимо найменше спільне кратне чисел відданих і приєднаних електронів: