Оксиди - це з'єднання, утворені атомами двох елементів. одним з яких є кисень в ступені окислення (-2).
До оксидів належать всі з'єднання елементів з киснем, наприклад Fe2 O3. P4 O10. крім містять атоми кисню, пов'язані хімічним зв'язком один з одним:
- пероксиди (Na2 O2);
- надпероксида (KO2);
- озоніди (KO2).
і сполуки фтору з киснем (OF2. O2 F2), які слід що назвати не оксидами фтору, а фторидами кисню. так як ступінь окислення кисню в них позитивна.
Фізичні властивості оксидів
Температури плавлення і кипіння оксидів змінюються в дуже широкому інтервалі. При кімнатній температурі вони, в залежності від типу кристалічної решітки, можуть перебувати в різних агрегатних станах. Це визначається природою хімічного зв'язку в оксидах, яка може бути іонної або ковалентного полярної.
У газоподібному і рідкому станах при кімнатній температурі знаходяться оксиди, що утворюють молекулярні кристалічні решітки. Зі збільшенням полярності молекул температури плавлення і кипіння підвищуються (таблиця 1).
Таблиця 1: Температури плавлення і кипіння деяких оксидів (при тиску 101,3 кПа)
Оксиди, що утворюють іонні кристалічні решітки, наприклад, CaO. BaO і інші є твердими речовинами, що мають дуже високі температури плавлення (> 1000⁰C) /
У деяких оксиди зв'язку ковалентні полярні. Вони утворюють кристалічні решітки, де атоми пов'язані кількома «мостіковимі» атомами кисню, утворюючи нескінченну тривимірну мережу, наприклад, Al2 O3. SiO2. TiO2. BeO і ці оксиди теж мають дуже високі температури плавлення.
Класифікація оксидів за хімічними властивостями
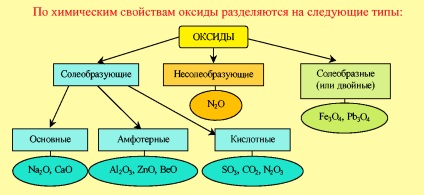
Несолеобразующіе оксиди - оксиди, яким не відповідають ні кислоти, ні підстави.
Солеобразние оксиди - це подвійні оксиди, до складу яких входять атоми одного металу в різних ступенях окислення.
Наприклад, Fe3 O4 → FeO · FeO3. являє собою основний оксид FeO хімічно пов'язаний з амфотерним оксидом Fe2 O3. який в даному випадку виявляє властивості кислотного оксиду. І Fe3 O4 формально можна розглядати як сіль, утворену підставою Fe (OH) 2 і кислотою [HFeO2]. яка не існує в природі:
Солеобразующіе оксиди - це оксиди, які утворюють солі. Оксиди цього типу поділяються на три класи: основні, амфотерні і кислотні.
Основні оксиди - оксиди, елемент яких при утворенні солі або підстави стає катіоном.
Кислотні оксиди - це оксиди, елемент яких при утворенні солі або кислоти входить до складу аніону.
Амфотерні оксиди - це оксиди, які залежно від умов реакції можуть проявляти як властивості кислотних, так і властивості основних оксидів.
При утворенні солей ступеня окислення елементів, що утворюють оксиди, не змінюються, наприклад:
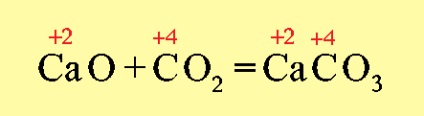
Якщо при утворенні солі відбувається зміна ступенів окислення елементів, що утворюють оксиди, то вийшла сіль слід віднести до солі інший кислоти або іншої основи, наприклад:
Fe2 (SO4) 3 являє собою сіль, утворену сірчаною кислотою і гідроксидом заліза (III) - Fe (OH) 3. якому відповідав би оксид Fe2 O3.
Утворилися солі є солями азотної (H +3 NO2) і азотної (H +5 NO3) кислот, яким відповідають оксиди:
Закономірності зміни властивостей оксидів
Збільшення ступеня окислення і зменшення радіусу його іона (при цьому відбувається зменшення ефективного негативного заряду на атомі кисню -δ0) роблять оксид більш кислотним. Це і пояснює закономірна зміна властивостей оксидів від основних до амфотерним і далі до кислотних.
А) В одному періоді при збільшенні порядкового номера відбувається посилення кислотних властивостей оксидів і збільшення сили відповідних їм кислот.
Таблиця 2: Залежність кислотно-основних властивостей оксидів від ефективного заряду на атомі кисню