1. Склад атома. Модель будови атома.
2. Стан електронів в атомі.
3. Будова електронних оболонок атомів 1-4 періодів.
4. Залежність властивостей елементів від електронної конфігурації. Електронегативність. Металеві і неметалеві властивості.
5. Поняття про хімічний зв'язок. Види зв'язку: ковалентний, іонна, металева. Полярність зв'язку. Валентність. Структурні формули.
6. Кристалічні решітки. Залежність властивостей речовин від типу кристалічної решітки.
7. Ступінь окислювання. Окислювально-відновні процеси.
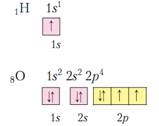
Атом - найдрібніша хімічно неподільна частинка, але ця частка має складну будову. У 1911 р Резерфордом була запропонована планетарна модель будови атома. Трохи пізніше - в 1913 р з'явилася теорія теорія Бора. Суть їх теорій сформулювати так:
У центрі атома знаходиться позитивне ядро, що займає незначну частину простору атома. Навколо ядра рухаються електрони, вони утворюють т.зв. електронну оболонку. Їх загальний заряд дорівнює заряду ядра атома, але з протилежним знаком. Атом - електронейтральна частинка.
Ядро атома складається з протонів і нейтронів, їх іноді називають нуклонами. Різні Види атомів з різним числом протонів і нейтронів називають нуклідами. У ядрі зосереджена майже вся маса атома. Маса протона 1 а.е.м. маса нейтрона 1 а.е.м. маса електрона = 1/1823 а.е.м. тому маса електронної оболонки мізерно мала в порівнянні з масою ядра. Число протонів в атомі називають протонним числом атома. Сукупність атомів з однаковим числом протонів називають хімічним елементом. Протонне число збігається з порядковим номером елемента в ПС. Ядро заряджена позитивно, а тому заряд протона = +1, нейтрона = 0, заряд ядра визначається числом протонів і дорівнює теж порядковому номеру елемента. Сума протонів і нейтронів називається масовим числом елемента. Тому що саме сума протонів і нейтронів визначає масу атома. Порядковий номер (протонне число) і масове (нуклонів) число - найважливіші характеристики атома. Їх вказують близько знака хімічного елемента, наприклад: 23, 11 Na. Якщо у атомів однакове число протонів, але різну кількість нейтронів, такі атоми називають ізотопами. Тобто Na Наприклад: 12, 6 За і 13 6 С. Іноді з іншого боку від знака хімічного елемента записують число нейтронів, тобто для 12 6 За - 12 6 За 6. а для 13 6 За - 13 6 За 7. Розрізняють стабільні і радіоактивні ізотопи. Знаючи масову частку всіх ізотопів хімічного елемента і їх масове число ми можемо обчислити середню атомну масу елемента.
Оскільки заряд ядра дорівнює заряду електронної оболонки, а у кожного електрона заряд (-1), то число протонів дорівнює числу електронів. Ці електрони рухаються по певних орбітах навколо ядра.
Ця модель атома дуже наочна і корисна. Але відразу виникло питання. Згідно електромагнітної теорії, рухаючись по орбіті з прискоренням електрон повинен безупинно випромінювати енергію, а значить він буде рухатися по спіралі і рано чи пізно впаде на ядро. До цього часу була доведена дискретність електричної енергії. Тому Бор висунув гіпотезу - рухаючись по орбіті електрон не випромінює енергії, це відбувається тільки при переході з однієї орбіталі на іншу.
Сучасна ТСА виникла як результат переосмислення і доповнення теорій Резерфорда і Бора. Найважливішим поняттям стало поняття про електронний хмарі, яке прийшло на зміну поняттю про електрон як частці. Сучасна теорія будови атома враховує хвильові властивості електрона.
У електрона двоїста природа. Як частка він має певну масу і заряд, а як хвиля - здатність огинати перешкоду (дифракція). Для електрона не можна одночасно точно виміряти координати і енергію. Він рухається з дуже великою швидкістю і характер руху у нього - імовірнісний. Тобто він рухається не по визначеній траєкторії, а хаотично, в просторі близько ядра, причому ймовірність перебування його в різних точках цього простору неоднакова. Це простір близько ядра, де перебування електрона найімовірніше називають електронним хмарою або електронною орбиталью.
Орбіталі мають певні розміри, форму і розташовуються в просторі певним чином. Для характеристики цих властивостей орбіталей використовують квантові числа. Їх всього 4.
Головне квантове число визначає розміри орбіталі, а значить і ступінь віддаленості від ядра. Саме від головного числа (розміру орбіталі) найбільше залежить енергія електрона. Орбіталі приблизно одного розміру утворюють електронний шар (електронний рівень). Число може мати значення n = 1,2,3,4 ... і чим більше значення n, тим більше, зазвичай, енергія електрона. Часто будова атома зображують у вигляді схеми:
тобто для натрію (№11) +11) 2) 8) 1
Рівні ділять на підрівні. Причому число можливих підрівнів дорівнює номеру цього рівня. Тобто на 1 рівні 1 підрівень, на 2 - 2, на 3 -3 і т.д.
Підрівні утворені орбиталями, однаковими не тільки за розміром, але і за формою. Цю форму орбіталі визначає друге (орбітальне) квантове число. Підрівні прийнято позначати буквами:
2 рівень - 2s, 2p
3 рівень - 3s, 3p, 3d
4 рівень - 4s, 4p, 4d, 4f ...
Третє квантове число називають магнітним, воно визначає орієнтацію орбіталі в просторі і їх число на підрівні. Для s -подуровня число таких орбіталей на будь-якому рівні дорівнює 1. Для р-підрівні - 3. Для d -5. Для f - 7 ...
Четверте орбітальне число характеризує власний стан електрона в атомі, яке, спрощено, можна уявити як момент власного обертання електрона. Воно може мати тільки два значення, тобто (Спрощено) обертання або в одну сторону, або в іншу. Цю характеристику електрона називають спіном, а число - спінові. Тобто електрони, які мають три однакових квантових числа повинні мати різне значення спина.
1). Правило Клечковского або принцип мінімуму енергії, тобто в стабільному (стаціонарному) стані електрони спочатку заповнюють орбіталі з меншим рівнем енергії. Енергія електрона залежить від суми головного і від орбітального квантового числа, то по зростанню енергії орбіталі утворюють ряд:
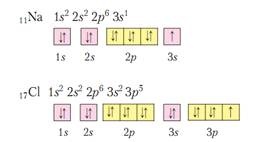
2). Принцип заборони Паулі, в атомі не може бути двох однакових електронів, т. Е. З однаковим набором 4-х квантових чисел. Значить на одній орбіталі може бути не більше двох електронів, причому, з протилежними спинами.
Орбіталі можна умовно зображати клітинами - осередками. І в одній клітці ми малюємо або ↓ ↑. або тільки ↓. або тільки ↑. Але ↑↑ - заборонено принципом Паулі.
3). Правила Гунда. На одному підрівні значення спінового числа електронів повинно бути максимально, а це значить, що заповнення електронами підрівні спочатку відбувається по одному, а тільки потім - відбувається спарювання. - заборонено!
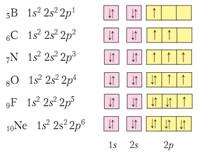
В освіті хімічних зв'язків зазвичай беруть участь електрони зовнішнього електронного шару. Їх прийнято називати валентними. У елементів побічних підгруп в утворенні зв'язків можуть брати участь і d-електрони. Число електронів на зовнішньому шарі для елементів головних підгруп (s і p елементи) дорівнює номеру групи і збігається з максимальною валентністю і максимальним ступенем окислення елемента.
Найбільш вигідною енергетично є електронна конфігурація заповненого електронного шару - s 2 p 6 (для 1 шару просто s 2). (Вигідними енергетично є також заповнені підрівні і наполовину заповнені підрівні). Тому всі елементи прагнуть завершити свою електронну шар, щоб мати таку конфігурацію. Для цього елементи або віддають валентні електрони, або приєднують їх, забираючи у інших атомів.
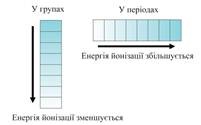

Елементи з високою ЕО відносяться до неметалів.
У періодах ЕО збільшується зі збільшенням номера, в підгрупах - зменшується. Поллинг вдалося виміряти цю ЕО і він розташував елементи в ряд:
Знаючи положення елемента в ПС ми може характеризувати його електронна будова і властивості.
Характеристика елемента по ПС (план)
1) положення в ПС (порядковий номер, період, група, підгрупа, атомна маса)
2) склад атома (число протонів, нейтронів, електронів)
3) розподіл електронів по рівнях, подуровням, орбиталям (схема будови, електронна формула, квантові осередки).
4) характеристика електронної будови і властивостей елемента та його сполук (число електронних шарів, завершено чи зовнішній електронний шар, скільки на ньому електронів, яка ЕО елемента, характерні ступені окислення; число неспарених електронів, вільних орбіталей, можлива валентність елемента, характеристика сполук елемента- оксиду і гідроксиду, ЛВС);
Висновок: металеві або неметалеві властивості елемента, і порівняння властивостей елемента з сусідами по періоду і підгрупі.
Тільки інертні гази в стандартних умовах перебувають в одноатомної стані. Всі інші, прагнучи завершити свій зовнішній електронний шар, утворюють хімічні зв'язки. Це прагнення мати 8 електронів на зовнішньому шарі називають правилом октету. Зазвичай, перед тим як вступити в хімічну реакцію атом повинен отримати додаткову енергію і перейти в збуджений стан.
Хімічна зв'язок має електронну природу, тобто утворюється за рахунок взаємодії між ядрами і електронами атомів. Існує кілька видів хімічного зв'язку.
Ковалентний зв'язок утворюється за рахунок загальних електронних пар. Вона характерна для неметалів, тобто елементів з високою ЕО.
Розрізняють ковалентну полярну зв'язок і ковалентний неполярну зв'язок (КП і КНП). Якщо атоми, що утворюють зв'язок однакові, то електронна пара в рівній мірі належить обом атомам, і зв'язок називають КНП. Якщо атоми різні, то електронна пара зміщена до більш ЕО атому, з'являються на атомах часткові заряди, «полюса», зв'язок КП.
Якщо елементи дуже сильно відрізняються по ЕО, тобто належать один до металів, інший до неметалів, то електрони повністю переходять до більш ЕО атому, утворюються реальні заряди на атомах. Атоми перетворюються в іони. Зв'язок між іонами називають іонної.
Прості речовини - метали утворюють особливий вид хімічного зв'язку, яку називають металевої. Вона здійснюється валентними електронами, які знаходяться в спільному володінні всіх атомів металу (електронний газ).
Безліч атомів з'єднуючись між собою утворюють речовини. У твердому стані речовини можуть мати впорядковану (кристалічну) і невпорядкованих (аморфну) структуру. Модель кристалічного стану речовини називають кристалічною решіткою. Залежно від виду частинок, які утворюють кристалічну решітку і типу хімічного зв'язку в ній прийнято розрізняти молекулярну, іонну, атомну і металеву решітку. Чим міцніше зв'язок між частинками, тим вище температура плавлення речовини, більше твердість. Чим полярних зв'язку, тим більша ймовірність розчинення речовини у воді.
Важливою характеристикою елемента є його ступінь окісленія.Степень окислення - це умовний заряд. який міг би з'явитися на атомі, якби всі електрони утворюють його хімічні зв'язки змістилися до більш електронегативного атома.