Елементи 6-ї групи головної підгрупи. Дуже часто вживане назва - халькогена - «руду народжують». Думаю, цією назвою вони більшою мірою зобов'язані сірці, ніж кисню 🙂
У форматі підготовки до ЄДІ ми розглянемо фізичні та хімічні властивості двох елементів - кисню O і сірки S.
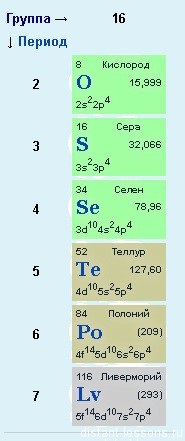
Але тут не все так просто.
До кисню претензій немає - у нього електронна будова відповідає загальній формулі, а ось у сірки та інших елементів є й інші варіанти ... Якщо детально розглянути будову p-елементів за періодами. то потрібно звернути увагу, що з 3-го періоду у p- елементів з'являється вільна d-орбіталь, на яку можуть переходити електрони.
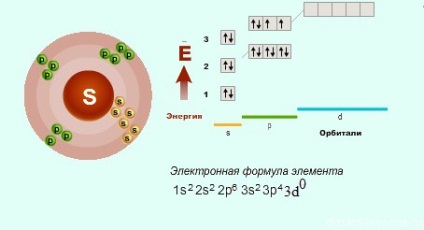
Саме тому ступінь окислення сірки може бути не тільки -2.
- Валентність елементів:
- валентність кисню = 2,
- валентність сірки - 2,4,6
- Ступені окислення:
- ступінь окислення кисню = -2 - типовий неметалл, сильний окислювач;
- ступінь окислення сірки = -2 (мінімальна ступінь окислення), +2 (рідко), +4, +6 (максимальний ступінь окислення) в мінімальній С.О. S буде проявляти відновні властивості. в максимальній - окисні.
- Зверху вниз в підгрупі радіус атома збільшується, отже, електрони все слабше притягуються до ядра атома, отже, зверху вниз металеві властивості збільшуються.
- Як наслідок цього зверху вниз в підгрупі посилюються відновні властивості.

Сірка - S - тверда речовина, хоча ми пишемо формулу цієї речовини як S. але зазвичай утворюються кристали складу S4 і S8. Зазвичай сірка - пластичне речовина коричневого або жовтого кольору.
На повітрі сірка горить: S + O2 = SO2 (безбарвний газ з різким запахом)
- Водень + кисень:
- 2H2 + O2 = 2H2O це якісна реакція на кисень - процес йде з характерним бавовною.
- H2 + O2 = H2O2 - перекис водню
- Метали + кисень:
- 4Li + O2 = 2Li2O - основний оксид
- Неметалл + O2:
- S + O2 = SO2 - кислотний оксид
- Оксиди + кисень:
- 4FeO + O2 = 2Fe2O3 - реакція йде з основними оксидами в невисшіх ступенях окислення
- 2SO2 + O2 = 2SO3 - реакція йде з кислотними оксидами в невисшіх ступенях окислення
Кисень може проявляти відновні властивості тільки до елементу, у якого більше електронний торгівельний, тобто він повинен стояти в періодичній системі елементів правіше кисню. Це КОРОЛЬ НЕМЕТАЛІВ - F:
- F2 + O2 = OF2 (тут кисень проявляє ступінь окислення +2)