4 Пігменти хлоропластів
Пігменти - найважливіший компонент апарату фотосинтезу. Вивчення рослинних пігментів різко прискорилося завдяки роботам російського фізіолога рослин М. С. Кольори. Намагаючись знайти спосіб поділу пігментів на індивідуальні речовини, Колір в 1901 - 1903 рр. відкрив принципово новий метод, який він назвав адсорбційної хроматографією. Через колонку з сорбентом пропускається розчинник з розчиненими речовинами. Так як речовини розрізняються за ступенем адсорбції, вони переміщаються по колонці з різною швидкістю. В результаті відбувається поділ речовин. Цей прийом широко використовується в сучасній біохімії, хімії і в деяких галузях промисловості. За допомогою хроматографічного методу Колір виявив два хлорофілу - а й b і розділив жовті пігменти листа на три фракції.
Пігменти пластид відносяться до трьох класів речовин: хлорофілу, фікобіліни і каротиноїдів.
4.1 Хлорофіли: склад, структура, біосинтез, оптичні і хімічні властивості, значення
Вперше хлорофіл в кристалічному вигляді був описаний російським фізіологом і ботаніком І. П. Бородіним в 1883 р Надалі виявилося, що це не сам хлорофіл, а трохи видозмінена його форма - етілхлорофіллід.
Польські біохіміки М. Ненцкий і Л. Мархльовський (1897) виявили, що основу молекули хлорофілу, як і гема гемоглобіну, становить порфириновой кільце. Таким чином було показано принципову структурну подібність цих пігментів у рослин і тварин.
Німецький хімік Р. Вильштеттер в 1906-1914 рр. встановив елементарний склад хлорофілу а - C55H72O5N4Mg і хлорофілу b - C55H70O6N4Mg, а німецький біохімік Г. Фішер в 1930-1940 рр. повністю розшифрував структурну формулу хлорофілу. У 1960 р хіміки-органіки Р.Б. Вудворд (США) і М. Штрелен (ФРН) здійснили штучний синтез хлорофілу. Хлорофіл - складний ефір дикарбонової кислоти хлорофіліну, у якій одна карбоксильна група етерифікування залишком метилового спирту, а інша залишком одноатомного непредельного спирту фитола. Структурна формула хлорофілу а представлена на малюнку:
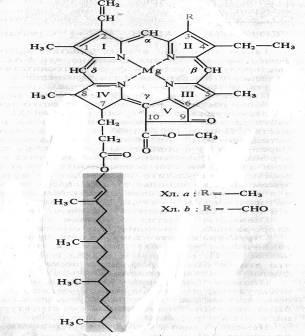
Чотири піррольних кільця (I - IV) з'єднані між собою метановими містками, утворюючи порфириновой ядро. Зовнішні атоми вуглецю в тетрапіррольних циклі позначені цифрами 1 - 10. Атоми азоту піррольних кілець чотирма координаційними зв'язками взаємодіють з атомом магнію. У структурі порфіринового ядра є також Циклопентанова кільце (V), утворене залишком кетопропіоновой кислоти і містить хімічно активну карбонільну групу у С9 і метильованих карбоксильну групу у С10. Структура, що складається з тетрапіррольних і циклопентанового кілець, отримала назву форбіна. Бічна ланцюг IV пиррольного кільця включає в себе пропионовую кислоту, пов'язану складноефірного зв'язком з полиизопреновой ненасичених спиртом фитолом (С20Н39ОН). У 1, 3, 5 і 8-го вуглеців піррольних кілець є метальними групи, у 2-го - вінільні, у 4-го - етільний група. Порфириновой кільце являє собою систему з дев'яти пар кон'югованих (пов'язаних) чергуються подвійних і одинарних зв'язків з 18 делокалізованних p-електронами. Хлорофіл b відрізняється від хлорофілу а тим, що у 3-го вуглецю замість метильної знаходиться формільная (-СНО) група. Структура хлорофілу, позбавлена фитола, називається хлорофиллид. При заміщенні атома магнію протонами в молекулі хлорофілів утворюються відповідні феофетіни.
У вищих рослин і водоростей виявлені хлорофіли а, b, с, d. Всі фотосинтезуючі рослини, включаючи всі групи водоростей, а також ціанобактерії, містять хлорофіли групи а. Хлорофіл b представлений у вищих рослин, у зелених водоростей і евгленовие. У бурих і діатомових водоростей замість хлорофілу b присутній хлорофіл c, а у багатьох червоних водоростей - хлорофіл d. У фотосинтезуючих бактеріях, які здійснюють фоторедукцію, знайдені різні бактеріохлорофіл.
Біосинтез хлорофілів. Перший етап біосинтезу хлорофілів у рослин - утворення 5-аминолевулиновой кислоти (А Л К) з С5-дикарбонових кислот. Показано, що глутамінова кислота через 2-гідроксіглутаровую перетворюється в 4,5-діоксовалеріановую, яка потім амінується за рахунок аланіну або інших амінокислот (рис. 5.2). Реакція переамінування каталізується АЛК-трансамінази за участю пиридоксальфосфата як кофермент. Для синтезу АЛК може використовуватися і оскетоглутаровая (2-оксоглутаровая) кислота. Циклизация двох молекул АЛК приводить до утворення пиррольного з'єднання - порфобилиногена. З чотирьох піррольних кілець формується уропорфіріноген, який перетворюється в протопорфирин IX. Подальший шлях перетворень протопорфирина може бути різним. За участю заліза формується гем, що входить до складу цитохромів, каталази, пероксидази і гемоглобіну. Якщо молекулу протопорфірину включається магній, потім карбоксильная група у С10 етерифікування метильной групою 6-аденозил-b-метіоніну і замикається Циклопентанова кільце (К), то утворюється протохлорофиллид. Під дією світла протягом декількох секунд протохлорофиллид перетворюється в хлорофиллид а в результаті гідрування подвійного зв'язку у С7 - С8 в IV піррольних ядрі. У нижчих рослин і деяких голонасінних (у хвойних) хлорофиллид може утворюватися в темряві. Хлорофиллид має ті ж спектральними властивостями, що і хлорофіл. Останній етап у формуванні молекули хлорофілу а - етерифікація фитолом, який, як і всі полиизопреновой з'єднання, синтезується з ацетил-KоА через мевалоновую кислоту. За даними А. А. Шлика (1965), хлорофіл b може утворюватися з знову синтезованих молекул хлорофілу а. Всі описані процеси, починаючи з освіти АЛК, здійснюються в хлоропластах. Перші ознаки зеленения, вирощених в темряві етіолірованних покритонасінних рослин, спостерігаються через 2 - 4 год після початку освітлення.
Фізико-хімічні властивості хлорофілів.
У твердому вигляді хлорофіл а являє собою аморфне речовина синьо-чорного кольору. Температура плавлення хлорофілу а 117 - 120 ° С. Хлорофіли добре розчинні в етиловому ефірі, бензолі, хлороформі, ацетоні, етиловому спирті, погано розчинні у петролейним ефірі і нерозчинні у воді. Розчин хлорофілу а в етиловому ефірі має синьо-зелений колір, хлорофілу b - жовто-зелений. Різко виражені максимуми поглинання хлорофілів лежать в червоною і синьою частинах спектра.
У етиловому ефірі максимуми поглинання хлорофілів групи а в червоній частині спектра - в межах 660 - 663 нм, у синій - 428 - 430 нм, хлорофілу b - відповідно в межах 642 - 644 і 452 - 455 нм. Хлорофіли дуже слабо поглинають помаранчевий і жовтий світло і зовсім не поглинають зелені і інфрачервоні промені. Поглинання в синьо-фіолетової частини спектра обумовлено системою кон'югованих одинарних і подвійних зв'язків порфіринового кільця молекули хлорофілу. Інтенсивна смуга поглинання в червоній області пов'язана з гидрированием подвійного зв'язку у С7 - С8 в IV піррольних ядрі (при переході від протохлорофиллида до хлорофиллид) і присутністю магнію в порфіринового кільця. Ці ж умови сприяють зниженню поглинання в жовтій і зеленій частинах спектра. Заміщення магнію протонами при обробці хлорофілу кислотою призводить до утворення феофетіна, що має буро-зелений колір і ослаблений червоний максимум поглинання. Видалення залишків фитола і метилового спирту шляхом лужного гідролізу мало позначається на спектрі поглинання хлорофілу. У хлорофіліну ті ж спектральні властивості, що й у хлорофілу: він зелений, має червоний і синій максимуми поглинання.
На положення максимумів спектра поглинання впливають природа розчинника та взаємодія молекул хлорофілу один з одним, а також з іншими пігментами, ліпідами і білками. У агрегованих молекул хлорофілу (наприклад, в твердих плівках і у хлорофілу, що знаходиться в хлоропластах) червоний максимум поглинання зрушать в більш довгохвильову область (до 680 нм).
Розчини хлорофілів в полярних розчинниках мають яскравою флуоресценцією (люмінесценцією). У етиловому ефірі у хлорофілу а спостерігається рубіново-червона флуоресценція з максимумом 668 нм, у хлорофілу b - 648 нм т. Е. Максимуми флуоресценції відповідно до правила Стокса кілька зрушені в більш довгохвильову частину спектру по відношенню до максимумів поглинання. Агрегований хлорофіл і хлорофіл в нативному стані (в живому аркуші) флуоресцируют слабо. Розчини хлорофілів здатні також до фосфоресценції (т. Е. Тривалого післясвічення), максимум якого лежить в інфрачервоній області.
Механізми флуоресценції і фосфоресценції, в тому числі молекул хлорофілу, досить добре вивчені. Найбільш стійкі ті стану атомів і молекул, в яких валентні електрони займають найнижчі енергетичні рівні і розподілені по ним згідно з принципом Паулі (не більше двох електронів з антипаралельними спинами на кожній орбіталі). Такий стан молекули називають основним синглетним (S0) енергетичним станом. Сумарний спін (вектор магнітних моментів) всіх електронів молекули в цьому випадку дорівнює нулю. Коли молекула поглинає квант світла, то за рахунок цієї енергії електрон переходить на більш високі вакантні орбіталі. Якщо у порушеної електрона зберігається той же напрямок спина, то молекула знаходиться в синглетному збудженому стані (S *). Якщо при переході на більш високу орбіталь спін електрона звертається, то таке порушення називається тріплетним (T *). Прямий перехід з основного стану в триплетное - малоймовірна подія, так як для цього необхідно звернення орієнтації спина. Переходу молекули з основного стану в збуджений, що відбувається при поглинанні кванта світла, відповідає смуга в спектрі поглинання.
Поглинання молекулою хлорофілу кванта червоного світла призводить до синглетному електронвозбужденному станом - S * 1.
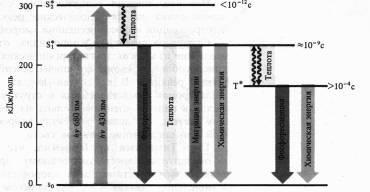
При поглинанні кванта синього світла з більш високим рівнем енергії електрон переходить на більш високу орбіту (S * 2). Збуджена молекула хлорофілу повертається в основний стан різними шляхами. Віддавши частину енергії у вигляді теплоти (особливо з рівня S * 1), молекула може випромінювати квант світла з більшою довжиною хвилі (правило Стокса), що проявляється у вигляді флуоресценції. Як уже зазначалося, хлорофіл а поглинає світло в червоною і синьою областях спектру, але флуоресціює лише в червоній. Час життя синглетного збудженого стану 10-13 - 10-9 с.
Інший шлях втрати енергії полягає в переході молекули з синглетного збудженого стану в метастабильное тріплетное (зі зверненням спина). Цей перехід безізлуча-вальний, т. Е. Енергія втрачається у вигляді теплоти. Тріплетное збуджений стан має набагато більший час життя (> 10-4 с). З триплетного стану молекула може повернутися в основне, випромінюючи ще більш довгохвильовий (чому в разі флуоресценції) квант світла. Це зазвичай більш слабке світіння і є фосфоресценція.
Нарешті, енергія збудженого стану може бути використана на фотохімічні реакції. В цьому випадку флуоресценції і фосфоресценції хлорофілу не спостерігається.
Структура молекули хлорофілу, відібрана в процесі еволюції з багатьох інших органічних пігментів, прекрасно пристосована до своїх функцій сенсибілізатора фотохімічних реакцій. До її складу входять 18 делокалізованних π-електронів (представлених в структурній формулі хлорофілу у вигляді 18-членного кільця з кон'югованих подвійних зв'язків), що робить молекулу хлорофілу легко збудливою при поглинанні квантів світла.
Ще Тімірязєв припустив, що хлорофіл здатний до окисно-відновного перетворення. Вперше реакція фотовідновлення хлорофілу була здійснена в модельних дослідах А. А. Красновський в 1948 р Хлорофіл, розчинений в піридині, в анаеробних умовах під дією світла відновлюється аскорбіновою кислотою або іншими донорами електронів. При цьому утворюється відновлена ( «червона») форма хлорофілу з максимумом поглинання при 525 нм:
Після вимикання світла реакція йде в зворотному напрямку. Фотовідновлення хлорофіл в свою чергу може відновлювати різні акцептори електронів. У тій же модельній системі, але з додаванням акцептора електронів хлорофіл при висвітленні діє як барвник:
У цих умовах відбувається відновлення NAD +, рибофлавіну, хинона, Fe3 +. кисню. Ці реакції отримали назву «реакцій Красновський». Таким чином, молекула хлорофілу може виступати не тільки в ролі первинного акцептора електрона, але і в ролі його первинного донора.
З усього сказаного випливає, що молекула хлорофілу завдяки структурним і фізико-хімічним особливостям здатна виконувати три найважливіші функції: 1) вибірково поглинати енергію світла, 2) запасати її у вигляді енергії електронного збудження, 3) фотохімічно перетворювати енергію збудженого стану в хімічну енергію первинних фотовідновлення і фотоокислення з'єднань.
Для функціонування молекули хлорофілу в процесах фотосинтезу істотне значення має її просторова організація. Магній-порфириновой кільце молекули представляє собою майже плоску пластинку товщиною 0,42 нм і площею 1 нм2. Це гідрофільна частина молекули хлорофілу. Довгий алифатический залишок фитола (2 нм), який утворює кут з порфіринового кільця - її гідрофобний полюс. необхідний для взаємодії молекули хлорофілу з гідрофобними ділянками мембранних білків і ліпідів.
Інформація про роботу «Фотосинтез як основа енергетики біосфери»