Основна функція ліпопротеїнів - транспорт ліпідів в організмі.
Розрізняють такі класи ліпопротеїнів:
-ліпопротеїни, або ЛВП, при електрофорезі на папері мігрують разом з глобулінами. ЛПВЩ багаті білком і фосфоліпідами.
-ліпопротеїни, або ЛПНЩ, відповідають за рухливості -глобуліну. Багаті холестерином.
Пре -ліпопротеіни, або ЛОНП, розташовані на ліпопротеінограмме між і -ліпопротеінамі. Головна транспортна форма ендогенних тригліцеридів.
Хіломікрони - при електрофорезі на папері не переміщаються ні до катода, ні до анода, залишаються на старті. Хіломікрони є основною транспортною формою екзогенних тригліцеридів.
При ряді захворювань ліпопротеїновий спектр сироватки крові змінюється. Встановлено 5 типів відхилень ліпопротеїнового спектра від норми.
Тип IV - гіпер пре- -ліпопротеінемія. Підвищення рівня ЛПДНЩ, N-ЛПНЩ, відсутність ХМ. Збільшення рівня ТГ при нормальному або злегка підвищений рівень холестерину. Клінічно поєднується з діабетом, ожирінням, на ішемічну хворобу серця.
Тип V - гіпер пре- -ліпопротеінемія або хіломікронемія. Підвищується рівень ЛПДНЩ, наявність ХМ. Клінічно ксантомаз, іноді поєднується з прихованим діабетом.
Хромопротеїди - складні білки, що складаються з білка і пов'язаного з ним пофарбованого небелкового компонента. Назва походить від грецького слова chroma - фарби.
Хромопротеїди ділять на 3 групи:
1. гемопротеидов - містять в якості простетичної групи залізо.
2. Магній - порфірини.
3. флавопротеїдів - містять похідні ізоаллоксазіна.
До групи гемопротеидов відносяться гемоглобін і його похідні, міоглобін і ферменти - цитохромними система, каталаза і пероксидаза.
Все хромопротеїди містять різні за складом і структурі білки. Небілковий компонент має структурним подібністю.
У молекулі гемоглобіну білковий компонент представлений білком глобіном, небілковий компонент - гем.
Глобине складається з 4 субодиниць 2 і 2. Кожна -ланцюг містить по 141 амінокислотному залишку, а - по 146.
Усередині кожної субодиниці є гідрофобний «кишеню», в якому розташовується гем.
Гем є плоскою молекулу, яка містить 4 піррольних циклу і з'єднаний з ними атом заліза:
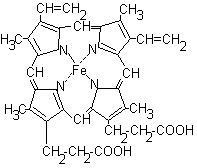
Гем з'єднується з білкової частиною (глобіном) гідрофобними зв'язками між піррольних циклами і гідрофобними радикалами амінокислот. Між атомом заліза і імідазольним кільцем одного із залишків гістидину в Глобиному є координаційна зв'язок. За рахунок ще однієї координаційної зв'язку до атому заліза може приєднуватися молекула кисню з утворенням оксигемоглобіну.
Піррольних кільця гема розташовані в одній площині, а атом заліза виступає з цієї площини. Приєднання кисню «випрямляє» молекулу гема: залізо переміщається в площину піррольних кілець і це викликає зміна конформації білка. У молекулі гемоглобіну є 4 протомеров, кожен з яких містить гем і може приєднувати кисень. Приєднання першої молекули кисню змінює конформацію протомеров. Зміна конформації одного протомеров змінює конформацію інших протомеров. Зміна конформації протомеров полегшує приєднання інших молекул кисню. Це явище називається кооперативним дією. Спорідненість гемоглобіну до четвертої молекулі О2 приблизно в 300 разів більше, ніж до першої.
Полягає у зв'язуванні та перенесення кисню від легенів до тканин. Гемоглобін, пов'язаний киснем, називається оксигемоглобіном.